Introduzione
Per Endodonzia Chirurgica s’intende quella branca dell’Odontoiatria che si occupa della diagnosi e del trattamento delle lesioni di origine endodontica che non rispondono alla terapia endodontica convenzionale o che non possono essere trattate con la terapia endodontica convenzionale.
Lo scopo dell’Endodonzia Chirurgica pertanto è quello di ottenere la detersione, sagomatura ed otturazione tridimensionale della porzione apicale del sistema dei canali radicolari non trattabili attraverso la cavità d’accesso, ma raggiungibili solo attraverso un lembo chirurgico (Fig. 1 a,b,c,d).
Per questo motivo si preferisce utilizzare il termine Endodonzia Chirurgica anziché Chirurgia Endodontica, in quanto l’intervento deve essere programmato ed eseguito come un intervento di endodonzia fatto attraverso un accesso chirurgico, e non solo come un intervento di chirurgia fatto per motivi endodontici.
Una volta che è stata fatta la diagnosi di insuccesso endodontico, è necessario capire quali sono state le cause che hanno portato all’insuccesso stesso per valutare successivamente se esiste la possibilità di correggere il fallimento con un ritrattamento ortogrado. Solo nel caso in cui questa possibilità non esista o, meglio, solo dopo che i tentativi di risolvere la terapia per via non chirurgica siano falliti, solo allora siamo autorizzati ad intervenire per via chirurgica. L’Endodonzia Chirurgica, in altre parole, non è il sostituto di un’endodonzia approssimativa e non deve essere una scappatoia per lasciare non “ritrattata” una terapia endodontica ortograda inadeguata (Fig. 2 a,b,c,d).
In accordo con quanto affermato da Nygaard-Ostby e Schilder,10 l’Endodonzia Chirurgica deve essere riservata a quei casi nei quali la preparazione e l’otturazione dei canali radicolari appaiono impossibili fin dall’inizio o quando i tentativi di ritrattamento non chirurgico siano falliti. Anche in questi casi, tuttavia, gli Autori raccomandano di riempire con le metodiche tradizionali la maggior parte possibile di canale prima di procedere all’intervento chirurgico.
Al giorno d’oggi le tecniche e gli strumenti per ritrattare clinicamente gli insuccessi endodontici si sono affinati talmente tanto che i casi che sicuramente presentano l’indicazione alla chirurgia e che non possono essere ritrattati per via ortograda sono sempre più scarsi. Spesso un’elevata esperienza in Endodonzia Chirurgica nasconde l’incapacità da parte dell’operatore di eseguire una corretta detersione, sagomatura ed otturazione tridimensionale del sistema dei canali radicolari per via non chirurgica.
Infine, anche dopo che è stata accertata l’indicazione alla chirurgia, in accordo con Weine e Gerstein,19 è consigliabile rimuovere il più possibile la precedente otturazione canalare inadeguata e sostituirla con guttaperca ben compattata: si possono così riempire canali laterali, canali addizionali precedentemente dimenticati e talvolta l’intervento chirurgico può rendersi non più necessario (Fig. 3 a,b,c).
Nei casi tuttavia in cui rimane l’indicazione alla chirurgia, è oggi possibile ottenere il successo della nostra terapia in una percentuale di casi notevolmente maggiore rispetto a quello che si poteva ottenere fino a pochi anni fa, e questo grazie ai progressi tecnologici recentemente avvenuti nel campo dell’Endodonzia Chirurgica.
Negli ultimi 10-15 anni due importanti fenomeni hanno completamente rivoluzionato l’Endodonzia Chirurgica: la preparazione con gli ultrasuoni della cavità retrograda e l’utilizzo del microscopio operatorio.
Gli ultrasuoni
Per molti anni l’apice radicolare è stato preparato chirurgicamente scavando con una fresa una cavità di prima classe all’interno della dentina, utilizzando un manipolo diritto a bassa velocità o il cosiddetto contrangolo “miniatura” (Fig. 4) con una piccola fresa rotonda o un cono rovescio.
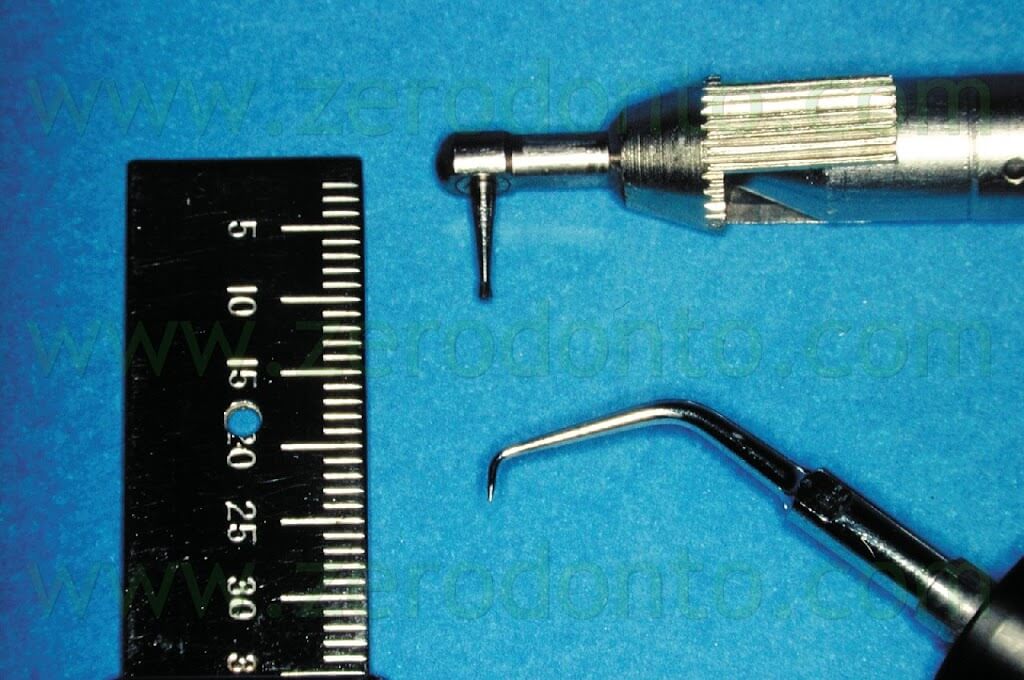
Questo tipo di approccio aveva molti svantaggi, ma soprattutto l’impossibilità di creare una preparazione in asse con il canale radicolare e inoltre comportava l’impossibilità di detergere la superficie vestibolare della cavità retrograda (Fig. 5).

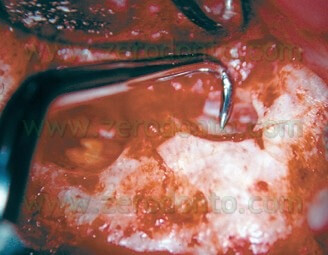
Nel tentativo di creare sufficiente ritenzione all’interno della cavità, era sempre presente il rischio di eseguire una perforazione palatina o linguale (Fig. 6 a,b,c) e la procedura era sempre più difficile a mano a mano che il canale radicolare era più lontano (linguale o palatino) e difficile da raggiungere da parte dell’operatore.
VIDEO
apicectomia
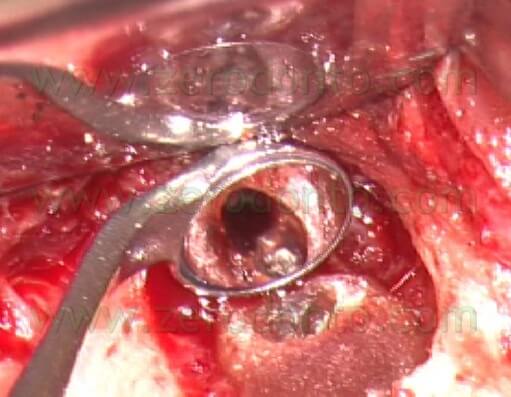
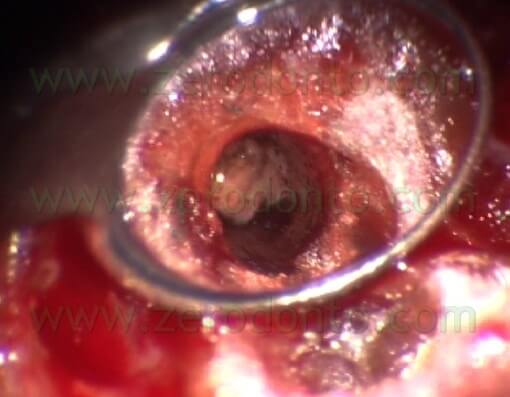
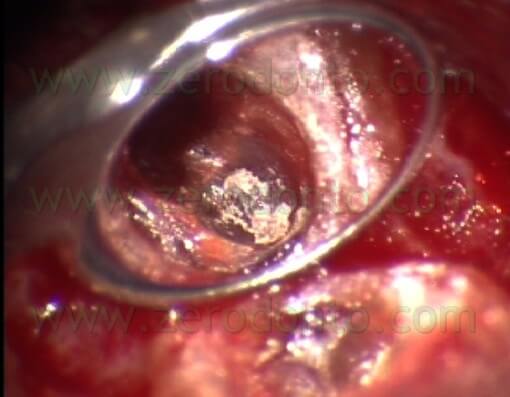
Le frese più piccole erano sempre troppo grosse paragonate al diametro dei canali radicolari e quindi le grandi cavità retrograde che risultavano erano più difficili da sigillare. Per lo stesso motivo, la cavità retrograda spesso non includeva le zone dell’istmo (Fig. 7 a,b,c,d).
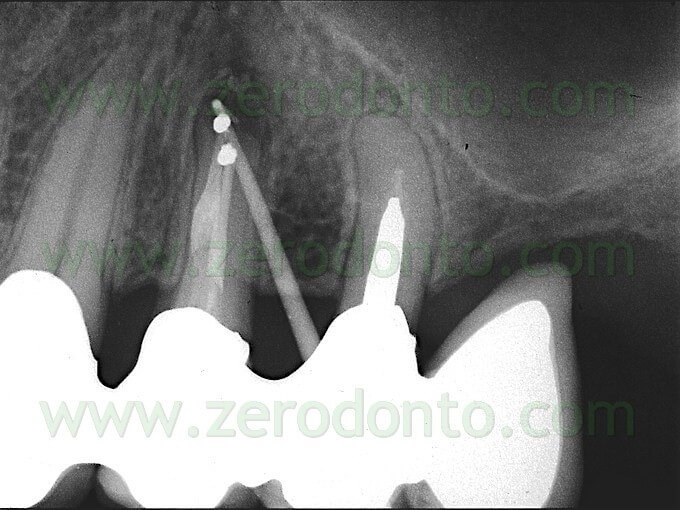

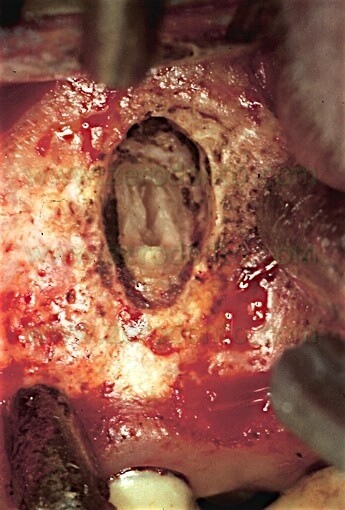

L’introduzione della preparazione della cavità retrograda con gli ultrasuoni ha reso possibile l’ottenimento di quella che viene definita come la cavità retrograda ideale: una cavità di prima classe, profonda almeno 3 mm all’interno della dentina, con pareti parallele e coincidente con il profilo anatomico dello spazio endodontico.1-3 Allo scopo di ottenere ciò, sono state sviluppate delle speciali punte da ultrasuoni che consentono al clinico di raggiungere qualsiasi radice in qualsiasi situazione clinica. L’utilizzo delle apposite punte specificatamente disegnate consente all’operatore di detergere il canale radicolare con un approccio apicale, lasciando pareti dentinali deterse non solo sull’aspetto linguale o palatino, ma anche sull’aspetto vestibolare, che era impossibile detergere invece con le precedenti tecniche. La cavità ora può essere fatta della profondità di 3 mm, senza la necessità di creare dei sottosquadri, in quanto non c’è alcun bisogno di ulteriore ritenzione. Le punte da ultrasuoni sono della medesima misura o addirittura hanno un diametro più piccolo del canale radicolare, per cui la preparazione della cavità retrograda può essere sigillata facilmente in maniera prevedibile nel massimo rispetto dell’anatomia originale. La zona dell’istmo può essere facilmente inclusa nella preparazione della cavità retrograda senza danneggiare o indebolire la radice, pur rimanendo estremamente conservativi nella dimensione mesio-distale.
Il microscopio
L’introduzione del microscopio operatorio (Fig. 8)

rappresenta l’altro importante progresso avvenuto nel campo dell’endodonzia chirurgica.2,13 Per molti anni la chirurgia periapicale è stata eseguita senza alcun ingrandimento, usando la lampada del riunito come unica sorgente di illuminazione per illuminare il campo operatorio. Nessuna sorpresa, pertanto, se fino a poco tempo fa la percentuale di successo dopo chirurgia era molto più bassa se paragonata a quella dell’endodonzia ortograda.4 Per migliorare la visibilità sono ad un certo punto diventati disponibili gli occhiali telescopici e le lampade frontali. Gli occhiali telescopici sono disponibili in una grande varietà di configurazioni e di ingrandimenti, da 2x fino a 6x, con ottica galileiana o prismatica. Con l’aggiunta delle lampade frontali con fibre ottiche si riesce a proiettare una luce coassiale nel campo chirurgico, per cui migliorano sia l’ingrandimento che l’illuminazione.
D’altra parte, quale ingrandimento è sufficiente? I clinici che hanno trovato beneficio nell’utilizzo degli occhiali telescopici e delle lampade frontali si sono presto resi conto dei limiti di questo sistema. L’ingrandimento di 6x, prima o poi, non è più sufficiente e la lampada frontale non è capace di indirizzare la luce in profondità all’interno del canale sia in endodonzia chirurgica che in endodonzia ortograda.
La risposta alla precedente domanda è: “quanto basta per vedere e risolvere il problema”. Il microscopio operatorio consente ingrandimenti da un minimo di 2,5x fino ad un massimo di circa 25x e l’illuminazione è perfettamente coassiale con la linea dello sguardo. L’illuminazione coassiale comporta due vantaggi: a) l’operatore può guardare all’interno del campo operatorio senza alcuna ombra e ciò significa che è possibile esaminare la detersione della cavità retrograda durante l’intervento di endodonzia chirurgica; b) dal momento che l’illuminazione coassiale è resa possibile nel microscopio operatorio dall’utilizzo di un’ottica galileiana e poiché l’ottica galileiana consente una messa a fuoco all’infinito e manda raggi di luce paralleli tra loro, gli occhi dell’operatore mettono anch’essi a fuoco all’infinito ed ogni intervento può essere eseguito senza alcun affaticamento visivo.
Per quanto poi riguarda l’ingrandimento, non c’è alcun bisogno di andare al di là dei 20 o 25x. Gli ingrandimenti minimi e medi vengono infatti utilizzati per lavorare, mentre gli ingrandimenti maggiori e massimi sono utilizzati solo per controllare i dettagli più fini. Lavorare a forti ingrandimenti significa avere una profondità di campo molto limitata ed un’illuminazione anch’essa limitata, per cui non è pratico.12
L’utilizzo del microscopio operatorio comporta numerosi vantaggi in endodonzia chirurgica:
a) una migliore visualizzazione del campo operatorio
b) una migliore valutazione della tecnica chirurgica
c) una maggiore accuratezza durante tutte le fasi dell’intero intervento
d) una migliore predicibilità di risultati a lungo termine.
Per questi motivi, l’Autore è fortemente convinto che l’endodonzia chirurgica non deve essere eseguita senza l’utilizzo del microscopio, a cominciare dall’iniezione della soluzione anestetica per terminare con la rimozione delle suture.
Sotto il microscopio, infatti, l’incisione fatta con le microlame è più accurata, con minor trauma per i tessuti molli, con un sollevamento più passivo del lembo e, più tardi, con un più facile riposizionamento dei tessuti. All’ingrandimento minimo può essere osservato l’intero campo chirurgico (Fig. 9) e si può cercare e reperire il nervo mentoniero (Fig. 10). 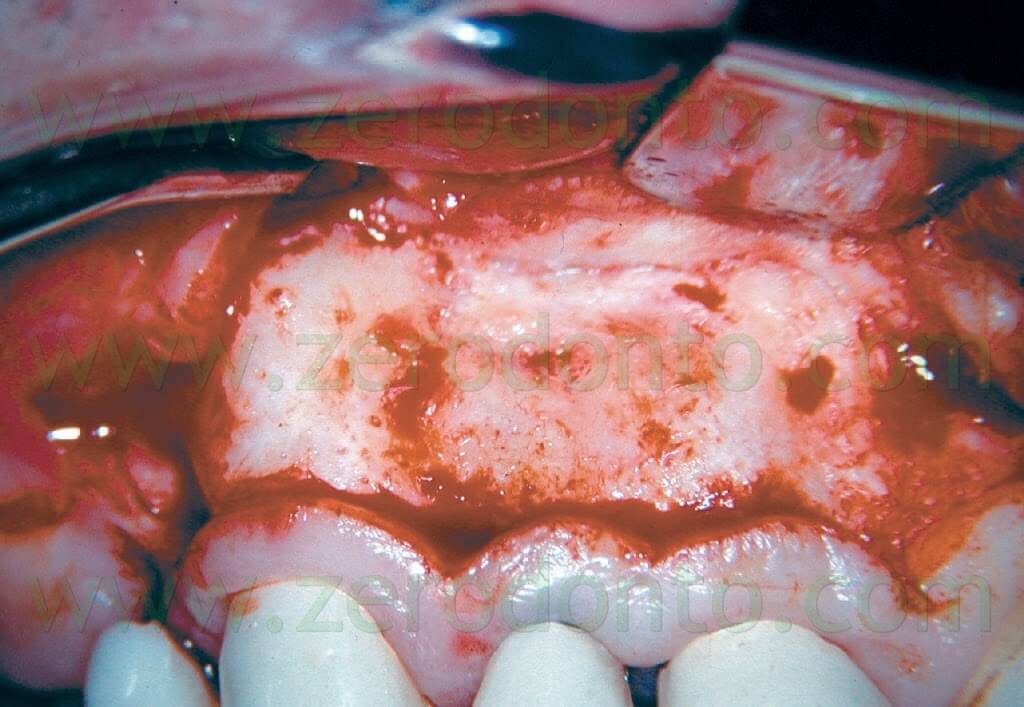
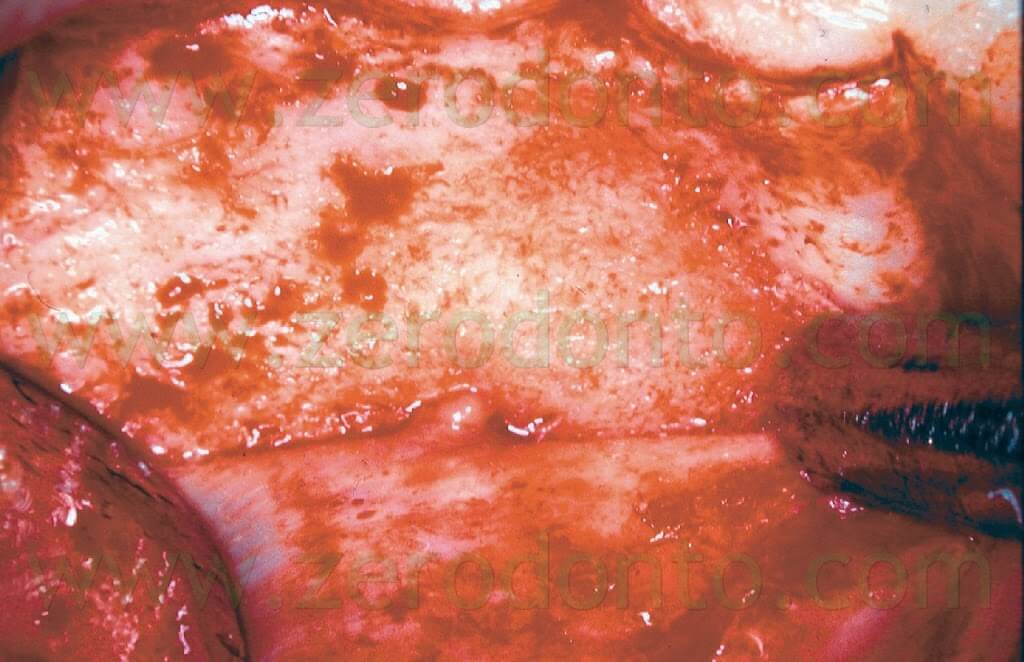
La misura della breccia ossea è di solito piccola (meno di 5 mm), sufficientemente grande per consentire l’introduzione delle punte da ultrasuoni, che hanno una lunghezza di circa 3 mm (Fig. 11).
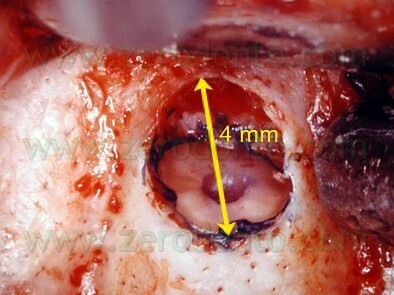
Lavorando a 10 o 20 ingrandimenti, la piccola osteotomia consente un controllo perfetto dell’intero intervento chirurgico.
Tecnica microchirurgica
Anestesia
In endodonzia chirurgica lo scopo dell’anestesia consiste nel fornire un’anestesia profonda non solo per la durata dell’intervento, ma anche per lunghi periodi di tempo dopo l’intervento e serve inoltre a garantire una buona emostasi.1 Per questo scopo, l’anestesia di elezione è rappresentata dalla lidocaina al 2% con epinefrina 1:50.000 (Fig. 12).
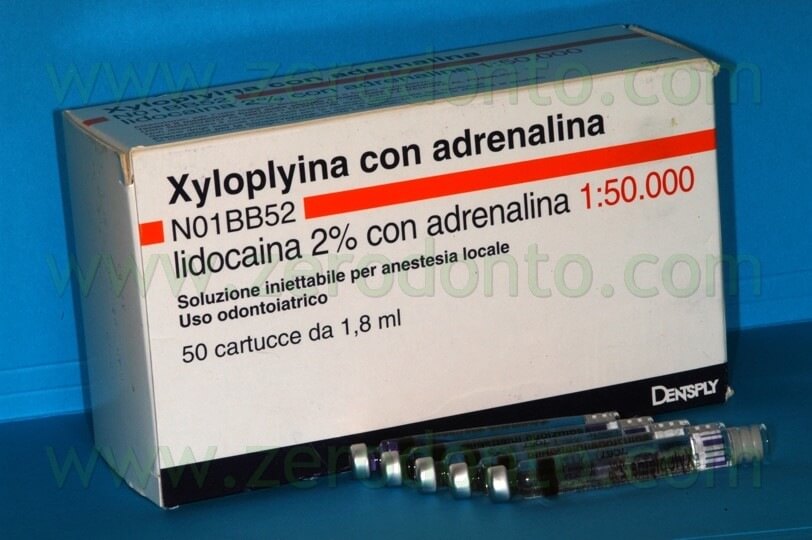
Le altre soluzioni anestetiche con minor concentrazione di epinefrina sono controindicate, in quanto l’eccessivo sanguinamento della zona chirurgica compromette la visibilità durante l’intervento. La lenta somministrazione della soluzione anestetica con epinefrina 1:50.000 non ha controindicazioni, nemmeno in pazienti compromessi da un punto di vista medico. L’utilizzo del microscopio anche durante la somministrazione dell’anestetico è di grande aiuto per evitare di iniettare vicino a grossi vasi capillari e può garantire l’assenza completa di sanguinamento dopo che l’ago è stato rimosso.
Incisione
Utilizzando sotto il microscopio i mini bisturi (Fig. 13) anche a piccolo ingrandimento, il chirurgo può eseguire delle incisioni molto precise con danni assolutamente minimi ai tessuti molli.

VIDEO
Se è presente una sufficiente quantità di gengiva aderente, è preferibile l’incisione mucogengivale, allo scopo di preservare l’esistente attacco epiteliale. Se invece esiste una quantità limitata di gengiva aderente o se esistono radici corte o lesioni periapicali di ampie dimensioni, o ancora quando deve essere esaminato l’aspetto cervicale della radice per il sospetto della presenza di una frattura verticale, in questi casi il lembo di elezione è quello di forma triangolare o rettangolare con un incisione sulculare. In entrambi i tipi di lembo il sollevamento deve essere sottominato (Fig.14 a,b,c),
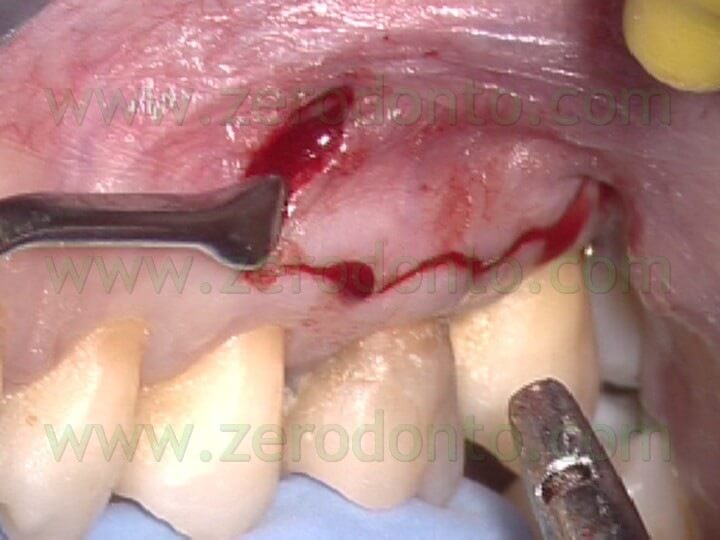
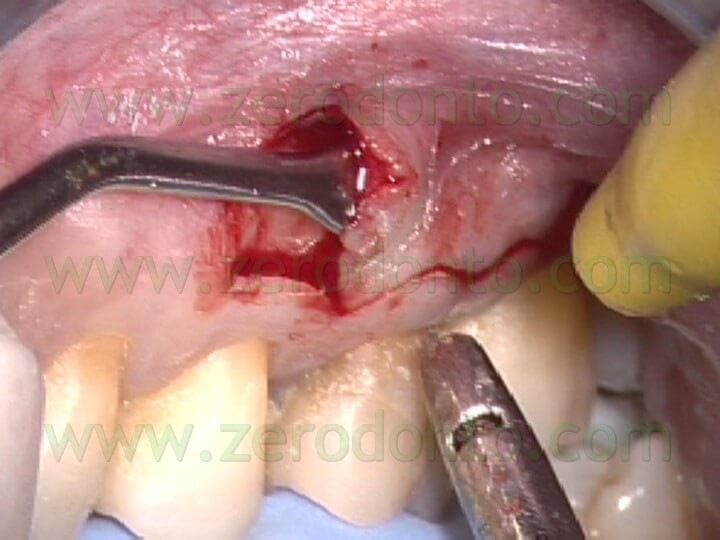
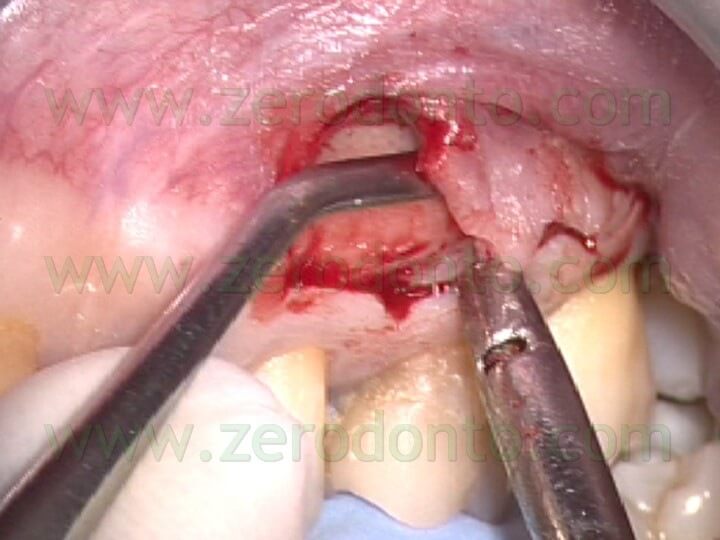
in maniera da ridurre il trauma ai tessuti molli: il sollevamento del lembo comincia a livello dell’incisione verticale di rilasciamento e continua verso i margini coronali in direzione apico-coronale. L’incisione mucogengivale inoltre è festonata, allo scopo di facilitare il riposizionamento dei tessuti, ma non è bisellata, come si faceva una volta. L’incisione veniva infatti fino a poco tempo fa eseguita bisellata allo scopo di non avere cicatrici. Recenti ricerche 1 e l’uso del microscopio hanno dimostrato invece che l’incisione a 90° rispetto al piano osseo sottostante (Fig. 15)
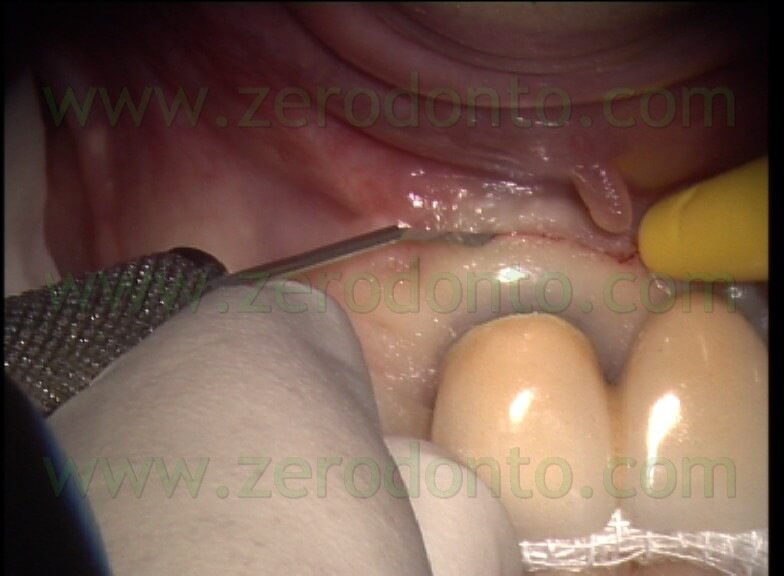
porta ad un riposizionamento e quindi ad una sutura molto più precisi e quindi ad una guarigione per prima intenzione, con assenza totale di cicatrice. L’incisione bisellata poteva portare allo scivolamento del lembo, ad uno scorretto riposizionamento e quindi alla guarigione per seconda intenzione, unica vera causa dell’esistenza di cicatrici.
Osteotomia
Utilizzando una fresa chirurgica rotonda montata su un l’apposito manipolo da alta velocità (Fig. 16) e sotto abbondante irrigazione con soluzione fisiologica, l’operatore comincia la rimozione di osso per isolare l’apice radicolare.

VIDEO
Se l’osso corticale è stato perforato dalla lesione, la localizzazione dell’apice radicolare è molto facile e la rimozione ossea è minima. Se invece l’osso corticale è ancora intatto, la gentile rimozione continua fino a che non viene percepita una differenza di colore: la dentina giallognola può essere infatti facilmente riconosciuta dall’osso bianco circostante. La breccia ossea deve essere sufficientemente ampia da consentire una buona visibilità e da permettere l’utilizzo di tutti gli strumenti necessari: curette, punte da ultrasuoni, micro-plugger. Una volta identificato l’apice radicolare, la lesione viene rimossa in toto per garantire un miglior controllo del sanguinamento e, in seguito, una più rapida guarigione. La rimozione completa della lesione è tuttavia controindicata nel caso in cui un curettage aggressivo potrebbe danneggiare strutture anatomiche vicine importanti, come il nervo mentoniero, il nervo alveolare inferiore, il seno mascellare, il pavimento delle fosse nasali o i peduncoli vascolari di denti adiacenti vitali. E’ ben noto infatti come la guarigione delle lesioni di origine endodontica proceda dopo la sola rimozione degli agenti contaminanti dal sistema dei canali radicolari e non semplicemente rimuovendo per via chirurgica il tessuto infiammato.1
Resezione apicale
La resezione apicale viene eseguita utilizzando una fresa ossivora di Lindemann (Fig. 17)

montata su manipolo da alta velocità specificatamente disegnato per la chirurgia orale (Fig. 18).

Esso è caratterizzato dall’avere la fuoriuscita di solo liquido di raffreddamento senza aria, per eliminare il pericolo di creare embolismi, ed inoltre la fresa è montata con un angolo di 45° per migliorare la visibilità sotto il microscopio, soprattutto nei settori posteriori. La resezione apicale viene eseguita quasi perpendicolarmente all’asse lungo della radice (Fig. 19 a,b)


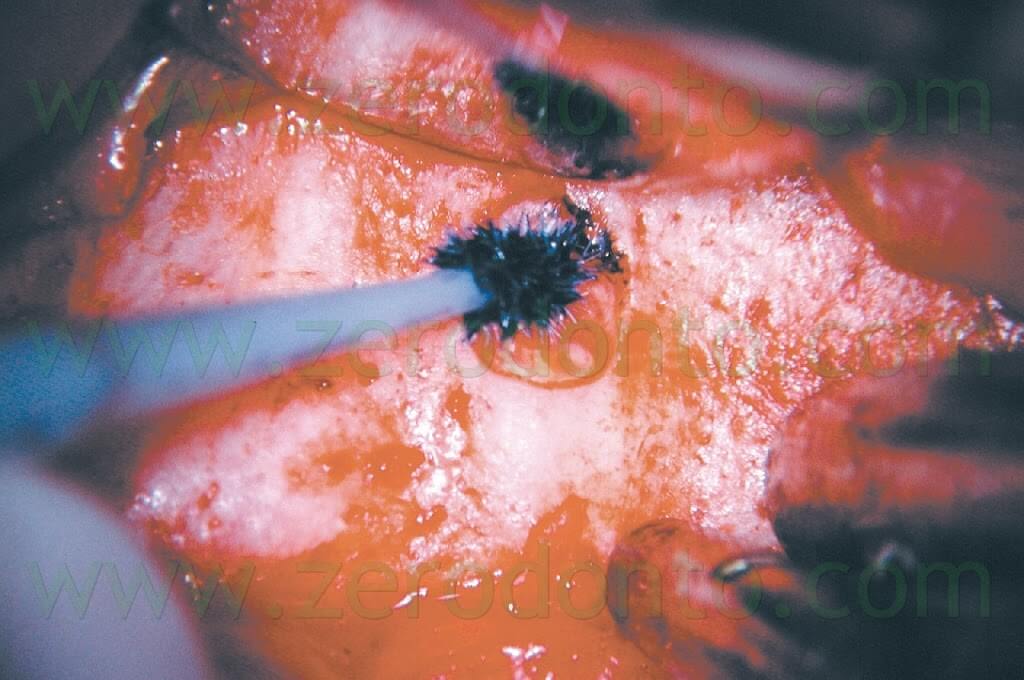
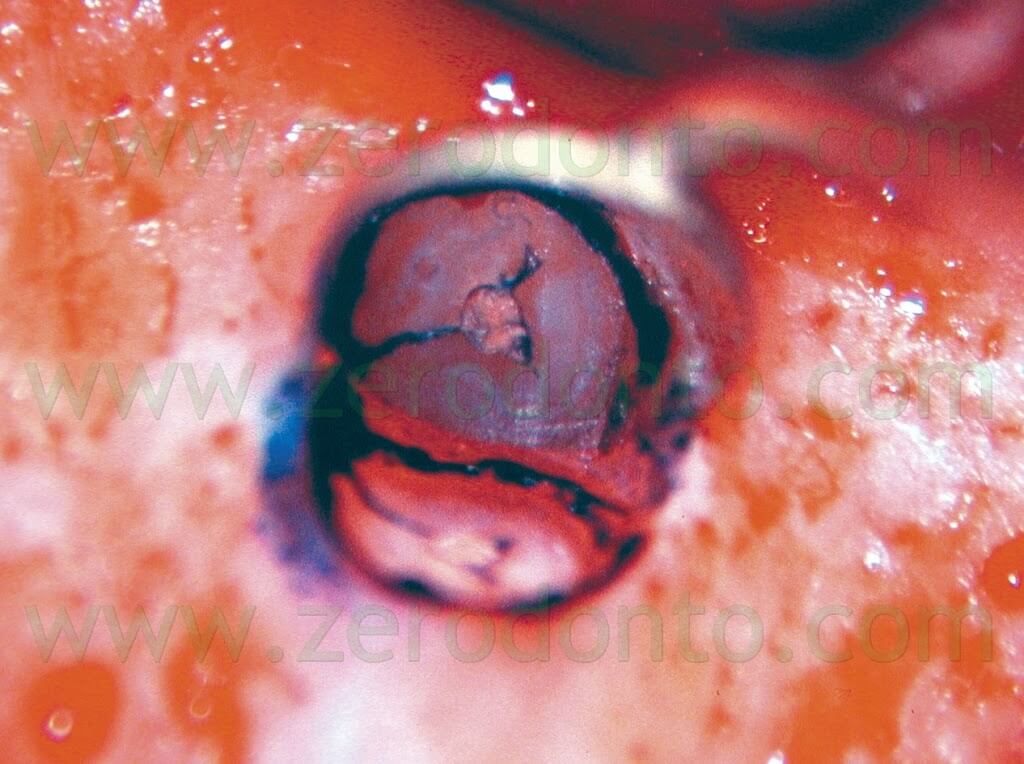
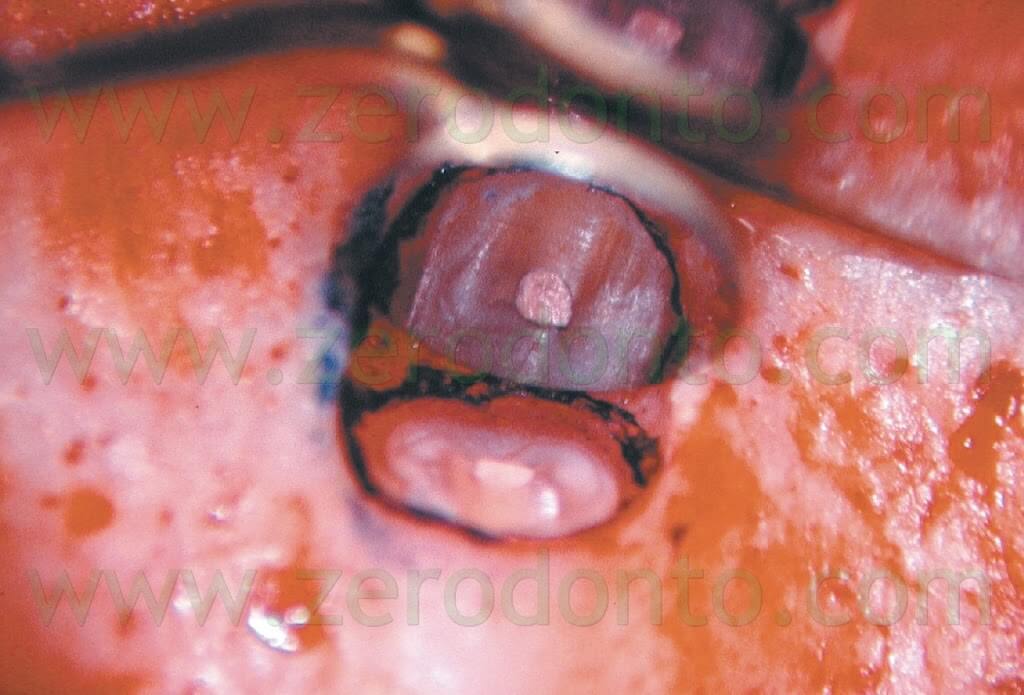
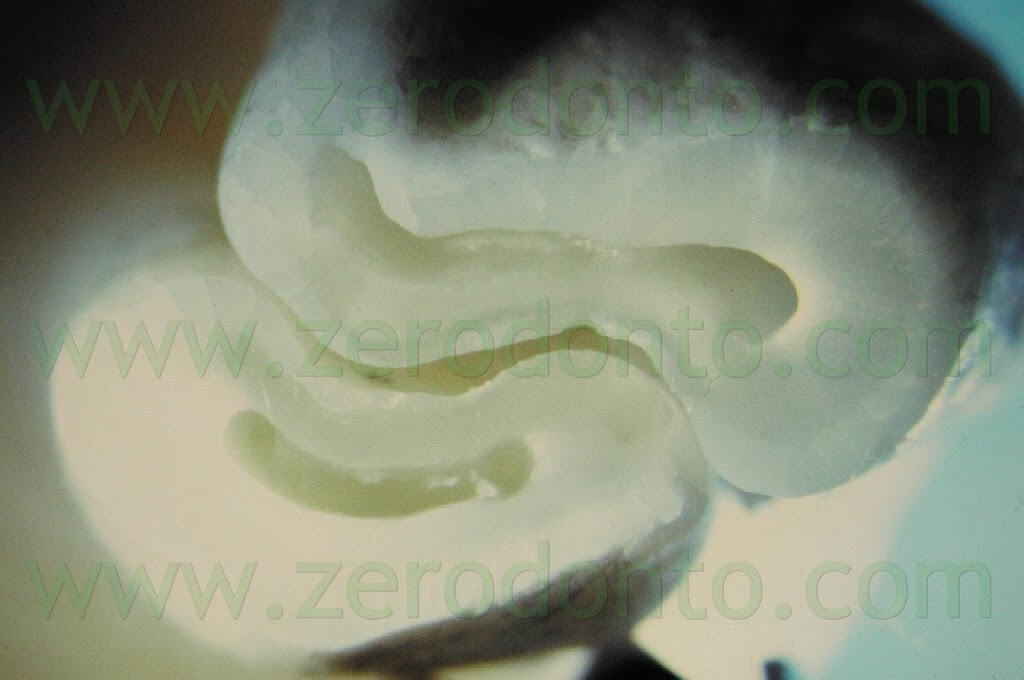
e deve essere completa sia in direzione vestibolo-linguale che in senso mesio-distale.1,6 Il microscopio è molto utile nella localizzazione del canale radicolare, per valutare la presenza di eventuali porte di uscita (canali laterali) accessorie, per localizzare e quindi eliminare l’eventuale materiale da otturazione estruso o l’eventuale vecchia otturazione in amalgama che sta fallendo. E’ utile inoltre per documentare l’esistenza di una eventuale frattura radicolare a partenza apicale e la presenza di canali accessori sulla superficie radicolare. Il metodo migliore per ispezionare la superficie della radice bisellata consiste nell’utilizzare una piccola quantità di colorante, come il blu di metilene (Fig. 20).
In questa maniera sarà molto più facile verificare se la radice è stata completamente sezionata, se è presente un istmo o se è presente una frattura verticale a partenza apicale (Fig. 21 a,b,c; Fig. 22).
Controllo del sanguinamento
E’ estremamente importante che l’otturazione retrograda venga eseguita in un campo asciutto. Per questo scopo, il sanguinamento all’interno della breccia ossea deve essere completamente eliminato e controllato. L’assistente dentale utilizza una piccola cannula aspirante e segue l’intero intervento attraverso il suo oculare al microscopio. In questa maniera, essa aiuta a mantenere il campo asciutto e quindi assicura all’operatore una buona visibilità. Se l’aspirazione non è sufficiente a mantenere il campo asciutto e ad allontanare il sanguinamento dalla superficie radicolare bisellata, si possono utilizzare poche gocce di soluzione anestetica con epinefrina 1:50.000 imbevendone una piccola garza sterile e premendola contro le pareti della breccia ossea per alcuni minuti.
Un’altra metodica ancora più efficace per eliminare completamente il sanguinamento dall’interno della breccia ossea consiste nell’utilizzo del solfato ferrico, che provoca un’ottima emostasi istantanea, avendo un pH estremamente basso (0,21) e causando una rapida coagulazione intravascolare (Fig. 23 a,b).
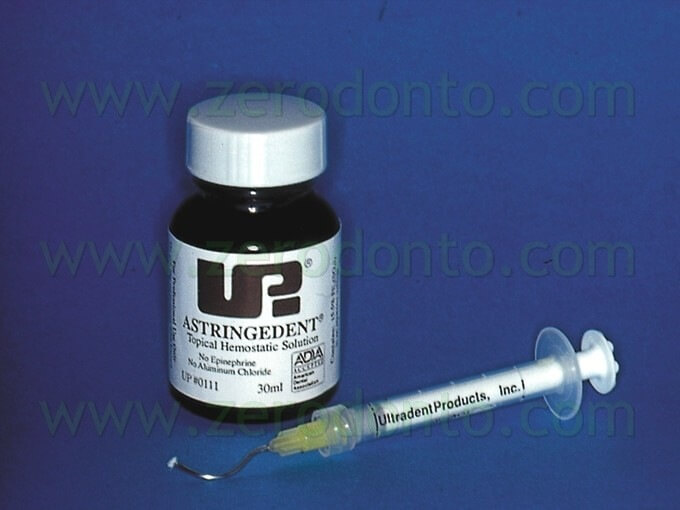

L’uso del solfato ferrico non ha controindicazioni, ma non deve essere utilizzato in contatto con importanti strutture anatomiche, come il nervo alveolare inferiore, il nervo mentoniero, il seno mascellare o il pavimento delle fosse nasali. Il suo uso deve anche essere evitato al di sopra dell’osso corticale o dei tessuti molli. Infine, quando l’otturazione retrograda è stata completata e prima della sutura, è imperativa la rimozione completa del solfato ferrico, allo scopo di evitare un ritardo nel processo di guarigione.8,9
Pertanto, con l’utilizzo di una curette l’operatore provvederà alla rimozione dei coaguli e alla stimolazione del sanguinamento.
Preparazione della cavità retrograda
Oggi è disponibile una grande varietà di punte da ultrasuoni da utilizzare per creare quella che è stata definita come cavità retrograda ideale. Sono anche disponibili in commercio numerose sorgenti di ultrasuoni appositamente disegnate per la preparazione della cavità retrograda. Le prime retrotip introdotte sul mercato sono quelle disegnate da Gary Carr 3 e disponibili in diverse misure, come le punte standard CT (Fig. 24)

e le punte più piccole chiamate SLIM JIM (Fig. 25).

Una punta particolare per lavorare in radici con una forte inclinazione linguale è la cosiddetta Back Action Tip, disegnata da Gary Carr (Fig. 26).
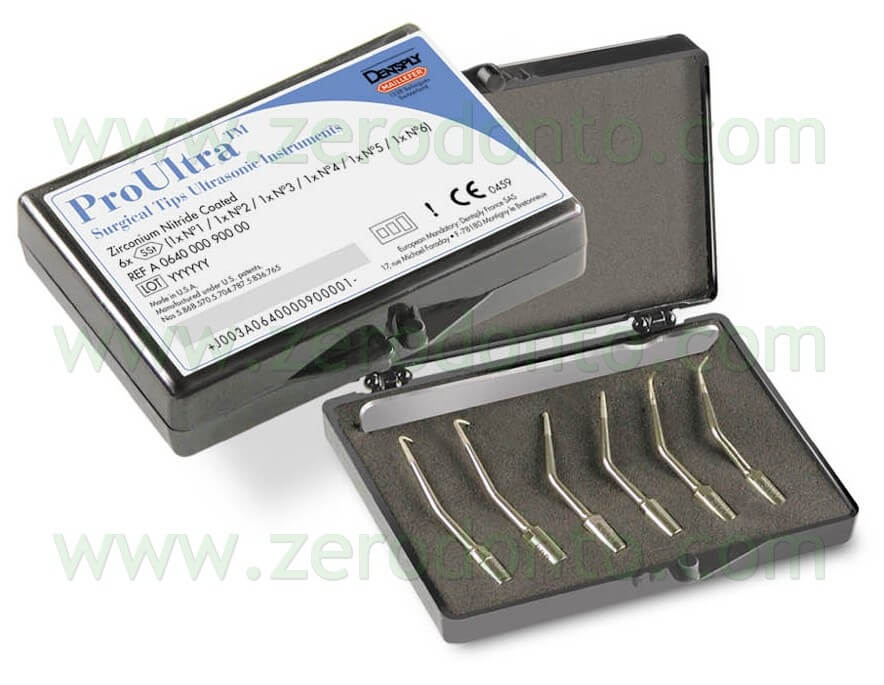
Recentemente, Syngcuk Kim e Cliff Ruddle hanno disegnato delle nuove punte fatte in acciaio e rivestite di nitrato di zirconio.
Si tratta delle punte da ultrasuoni KiS (Obtura Spartan) e delle ProUltra (Dentsply, Tulsa Dental) (Fig. 27a).
Queste nuove punte hanno numerosi vantaggi:
a) sono più aggressive e tagliano la dentina più rapidamente, senza necessità di dover insistere a lungo con gli ultrasuoni
b) la porta di irrigazione è stata posizionata vicino alla punta lavorante, con aumentata efficacia e maggiore quantità di irrigazione durante la preparazione della cavità retrograda (Fig. 27b)

c) sono leggermente più lunghe delle altre punte, per consentire un migliore accesso nelle zone difficili da raggiungere.
Sono anche disponibili punte rivestite di diamante, come quelle disegnate da Elio Berutti (Fig. 28).

Molto utili sono anche le punte disegnate da Bertrand Khayat BK3, con tre diverse curvature, appositamente create per raggiungere zone di difficile approccio (Fig. 29).

Le punte da ultrasuoni devono essere posizionate perpendicolarmente alla superficie radicolare e parallelamente all’asse lungo della radice (Fig. 30) e successivamente essere attivate.
VIDEO
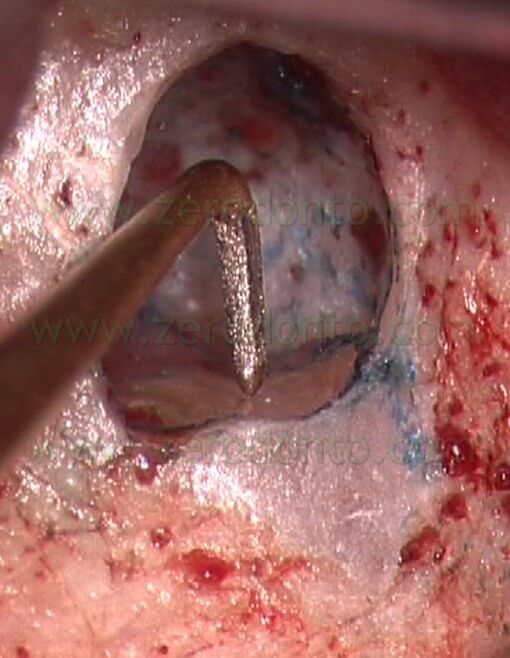
Le punte devono penetrare all’interno del vecchio materiale da otturazione senza incontrare alcuna resistenza. Esse, inoltre, devono essere attivate solo all’interno del canale radicolare e disattivate prima di essere rimosse dal canale. Questo allo scopo di evitare di eseguire graffi o danni di qualsiasi genere sulla superficie radicolare bisellata. La rimozione della precedente otturazione retrograda in amalgama fallita è anch’essa facilitata dall’utilizzo delle punte da ultrasuoni, che molto spesso possono rimuovere la vecchia otturazione in un unico pezzo senza creare polvere, eliminando così i rischi di tatuaggio. Se la radice che deve essere trattata ha due o più canali, l’operatore deve prestare molta attenzione e cercare la presenza dell’istmo. Esso infatti contiene tessuto pulpare e frustoli come qualsiasi altro spazio endodontico e pertanto deve essere deterso e incorporato nella preparazione della cavità retrograda (Fig. 31).
 La mancata preparazione e il mancato sigillo dell’istmo rappresentano un invito al fallimento (Fig. 32 a,b).
La mancata preparazione e il mancato sigillo dell’istmo rappresentano un invito al fallimento (Fig. 32 a,b).
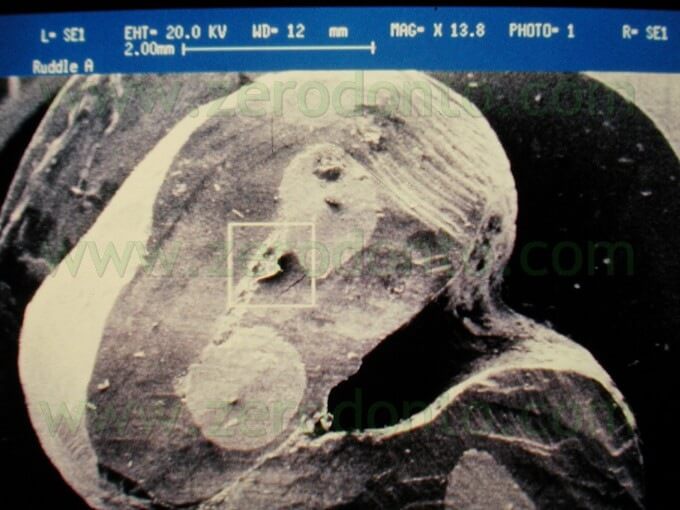

L’istmo talvolta può essere così sottile da essere difficile da osservare anche sotto il microscopio. Pertanto, come regola generale, in tutte le radici con più canali l’istmo deve sempre essere preparato, anche se non lo si riesce a vedere nemmeno con il microscopio.
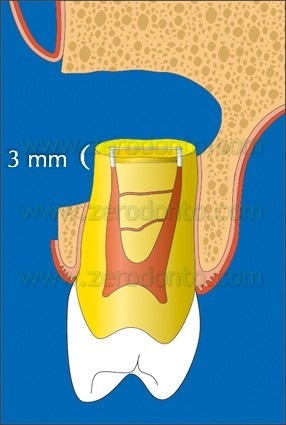
Una volta che è completata la preparazione della cavità retrograda con gli ultrasuoni, si esamina la sua completezza. Se sono ancora presenti frustoli, l’operatore può usare nuovamente le punte da ultrasuoni, irrigare ed esaminare di nuovo la preparazione. La cavità deve essere profonda 3 mm (Fig. 33),
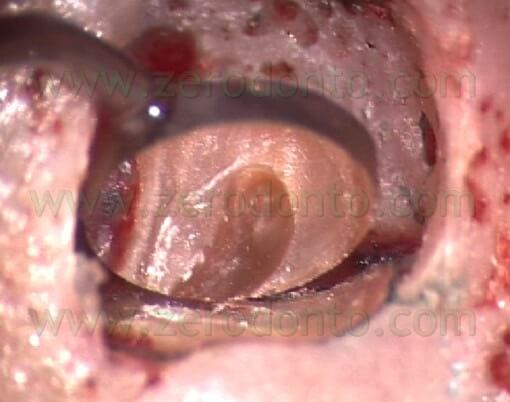
con le pareti completamente libere dalla vecchia otturazione in guttaperca o dal vecchio cemento (Fig. 34).
VIDEO
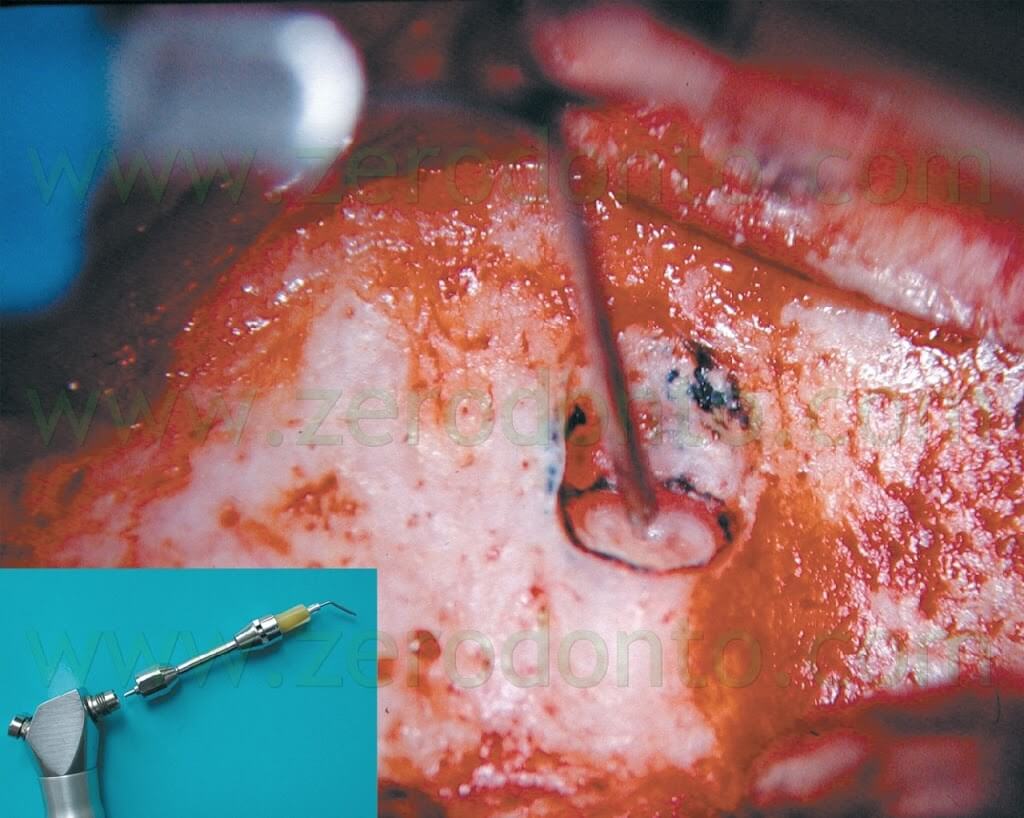
Il microscopio operatorio è di importanza essenziale per esaminare l’accuratezza della preparazione della cavità e questo può essere fatto utilizzando i microspecchietti (Fig. 35),

dopo che la cavità è stata irrigata con soluzione fisiologica ed asciugata con un leggero getto di aria utilizzando la siringa fornita dell’irrigatore di Stropko15 (Fig. 36).
Materiali per otturazione retrograda
Dal punto di vista storico, l’amalgama è stato il materiale di scelta per otturazioni retrograde per molti anni, ma oggi non è più utilizzata, in quanto essa presenta numerosi svantaggi, come la corrosione, l’espansione e l’infiltrazione. Al giorno d’oggi, i materiali più diffusamente accettati come materiali da otturazione retrograda sono i cementi a base di ossido di zinco-eugenolo, come l’IRM e il Super EBA 11 ed il Mineral Trioxide Aggregate (ProRoot MTA).18
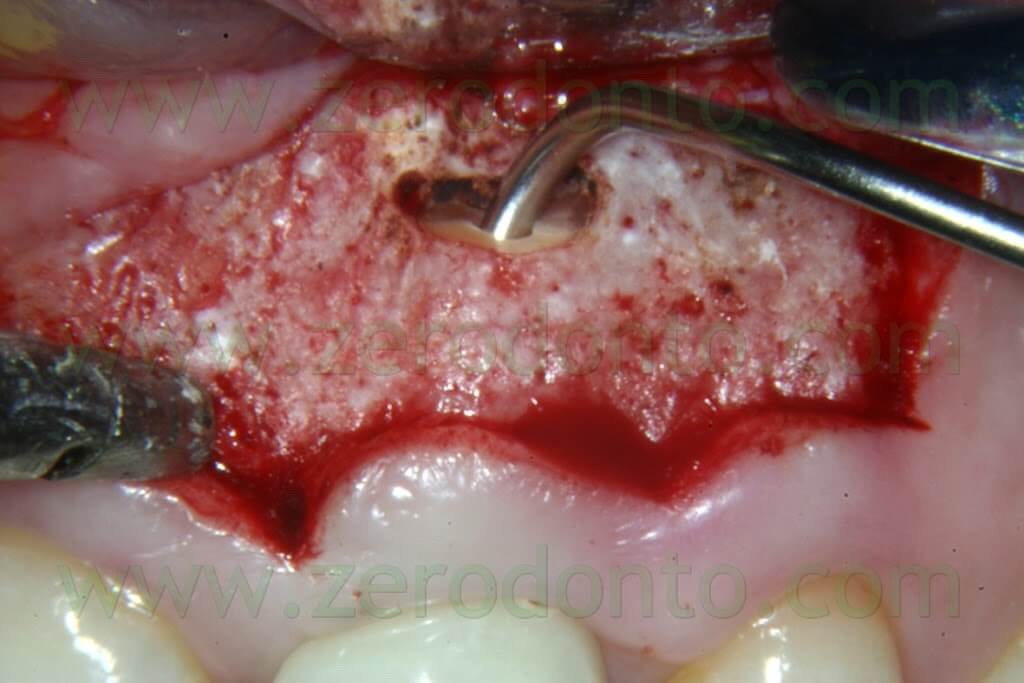
I primi sono facili da manipolare, hanno un tempo di lavorazione adeguato, sono dimensionalmente stabili, sufficientemente biocompatibili, non sono danneggiati dalla presenza di umidità, hanno azione batteriostatica, sono radiopachi, non provocano scolorimento del dente o dei tessuti molli circostanti e sono facili di rimuovere. Il cemento Super EBA viene mescolato fino ad ottenere una consistenza molto densa, sagomato a forma di piccoli coni che restano aderenti all’estremità di un piccolo escavatore o di una piccola spatola con i quali vengono portati all’interno della preparazione apicale 13 (Fig. 37).
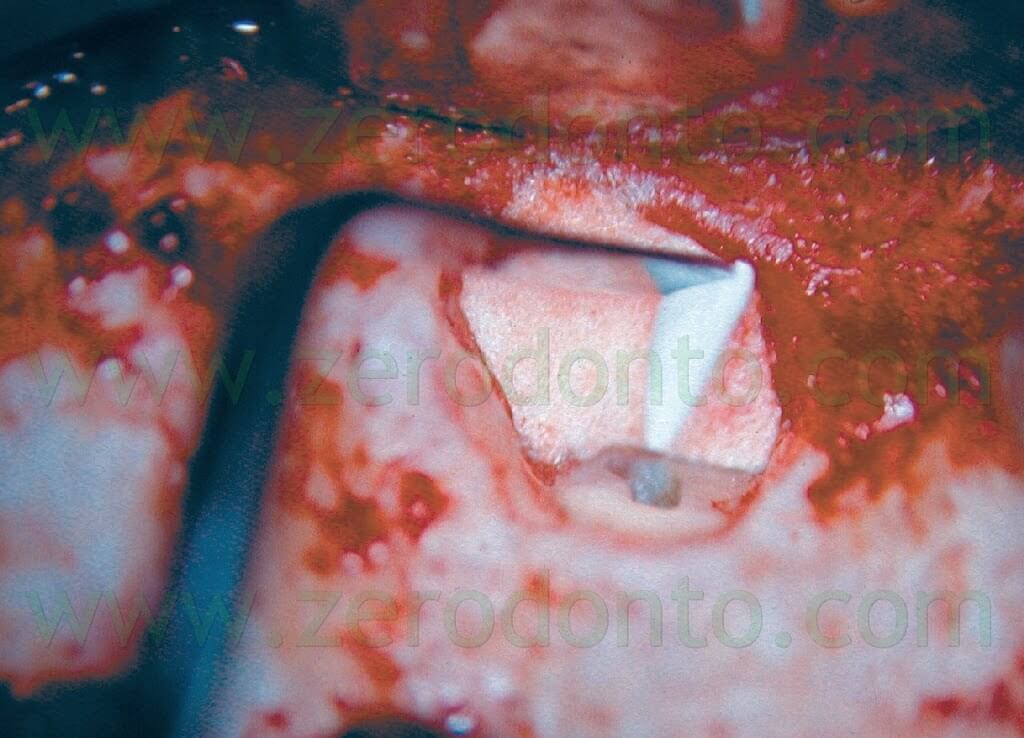
Il cono di materiale raggiunge la base della cavità retrograda, mentre i lati del piccolo cono prendono contatto con le pareti. Dopo ogni introduzione di materiale, si utilizza un plugger precedentemente tarato per condensare il Super EBA all’interno della cavità. Il materiale viene condensato in eccesso al di sopra della superficie bisellata della radice utilizzando un brunitore a palla. Una volta che il cemento è indurito, si utilizza una fresa per rifinire l’otturazione retrograda. Si controlla quindi a forte ingrandimento l’integrità del Super EBA dopo che la superficie è stata nuovamente asciugata con l’irrigatore di Stropko. Si esegue quindi una radiografia post-operatoria, dopodiché l’operatore è pronto per riposizionare i tessuti ed eseguire la sutura.
I cementi a base di ossido di zinco-eugenolo, come già detto, sono facili da manipolare ma al tempo stesso presentano non pochi inconvenienti, e tra questi il più grave è rappresentato dalla loro sensibilità alla presenza di umidità.18
D’altra parte è ben noto ed universalmente accettato che l’isolamento del campo operatorio per il controllo dell’umidità rappresenta un grosso problema in odontoiatria in generale ed in restaurativi ed in endodonzia in particolare. Per poter eseguire una corretta otturazione del sistema dei canali radicolari questi devono essere asciutti se vogliamo ottenere un buon sigillo, e deve essere accuratamente evitata la contaminazione col sangue. Durante l’esecuzione di un incappucciamento pulpare diretto l’eventuale emorragia deve essere tenuta sotto controllo. Quando ci si accinge a riparare una perforazione, è essenziale ottenere un campo asciutto. Infine, durante un intervento di endodonzia chirurgica la cavità retrograda deve essere completamente asciutta.
In alternativa ai cementi a base di ossido di zinco-eugenolo, un nuovo materiale è stato recentemente introdotto in endodonzia chirurgica come materiale per otturazioni retrograde 14,16-18 (Fig. 38).

Il Mineral Trioxide Aggregate (MTA) è una polvere che consiste di piccole particelle idrofile di silicato tricalcico, alluminato tricalcico, ossido tricalcico e ossido di silicio. Contiene anche piccole quantità di altri ossidi minerali che modificano le sue proprietà chimiche e fisiche e rendono il materiale radiopaco. L’idratazione della polvere risulta in un gel colloidale che solidifica in una struttura dura in circa 3-4 ore.
Questo cemento è diverso dagli altri materiali attualmente in uso, grazie alla sua biocompatibilità, alle sue proprietà antibatteriche, al suo adattamento marginale e proprietà sigillanti, ma più di ogni altra cosa per la sua idrofilia.17
I materiali precedentemente usati per sigillare una cavità retrograda in endodonzia chirurgica sono inevitabilmente in contatto con il sangue e con altri fluidi tissutali. L’umidità può giocare un ruolo importante per il suo potenziale effetto sulle proprietà fisiche e sulle capacità sigillanti dei materiali restaurativi.16 Come è stato dimostrato da Torabinejad e coll.16, l’MTA è l’unico materiale che non è danneggiato se viene in contatto con il sangue o con un ambiente umido: la presenza o l’assenza del sangue sembra infatti non influenzare le proprietà sigillanti del Mineral Trioxide Aggregate. Addirittura, l’MTA indurisce solo in presenza di umidità.17 Per questi motivi, l’MTA è considerato oggi il materiale di elezione per gli incappucciamenti diretti,17 per l’otturazione degli apici immaturi,17 per riparare le perforazioni 17 e per sigillare le cavità retrograde in endodonzia chirurgica.
In conclusione, il Mineral Trioxide Aggregate (ProRoot, Dentsply Tulsa Dental) ha numerosi vantaggi:
a) è facile da mescolare e da posizionare all’interno della cavità con gli appositi piccoli carrier
b) dal momento che indurisce in presenza di umidità, non è sensibile all’ambiente umido e non viene danneggiato se contaminato dal sangue
c) sigilla meglio rispetto all’amalgama, al Super EBA e all’IRM
d) ha un migliore adattamento alle pareti di dentina circostante
e) ha un’eccellente biocompatibilità
f) attiva la cementogenesi (Fig. 39 a,b; Fig. 40 a,b,c).
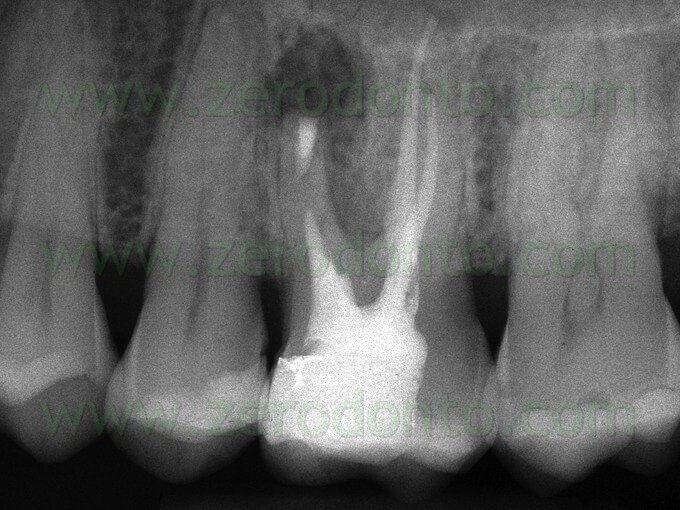
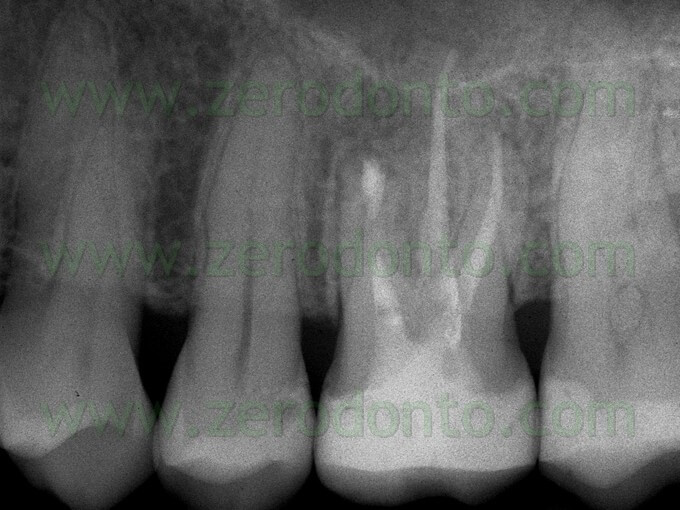
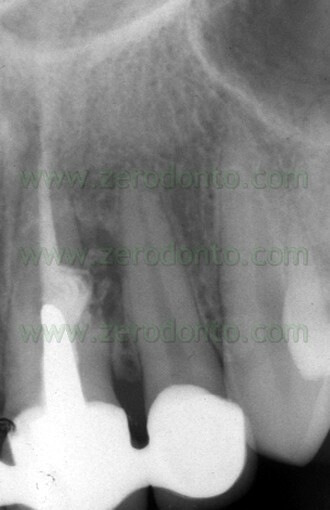

Uno svantaggio che è emerso quando si è cominciato ad usarlo sta nel fatto che non è di facile manipolazione e quando questo materiale è stato introdotto nel commercio non esisteva un adeguato carrier per posizionarlo durante le sue diverse applicazioni.
Il primo carrier che divenne disponibile fu il Dovgan Carrier (Quality Aspiratore) (Fig. 41),
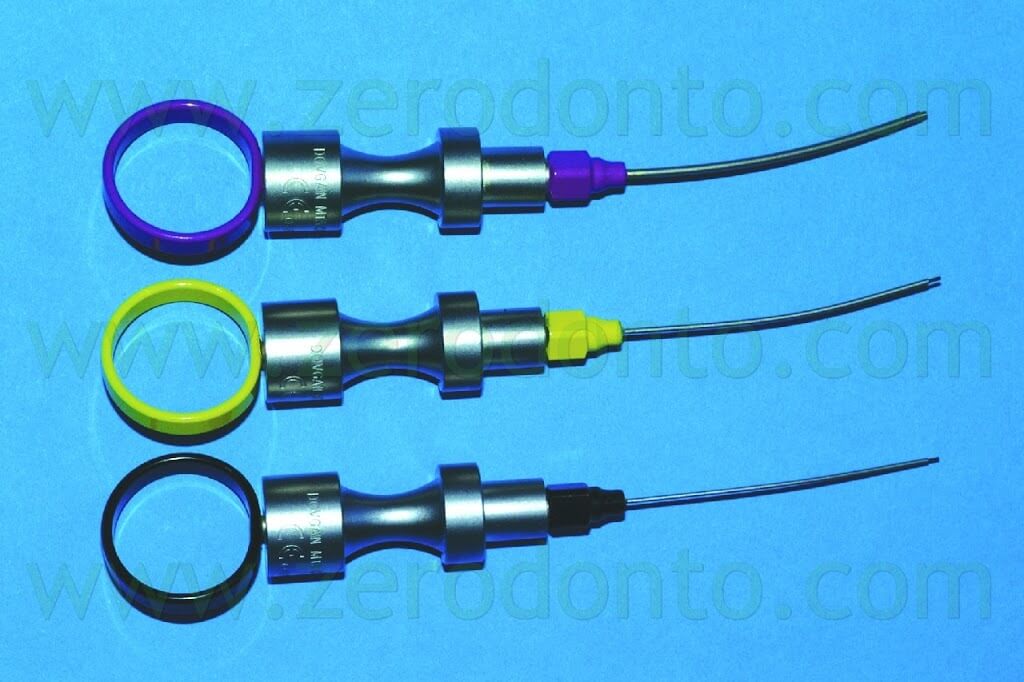
ma anche se i suoi aghi erano precurvabili, il suo utilizzo in chirurgia risultava piuttosto scomodo.
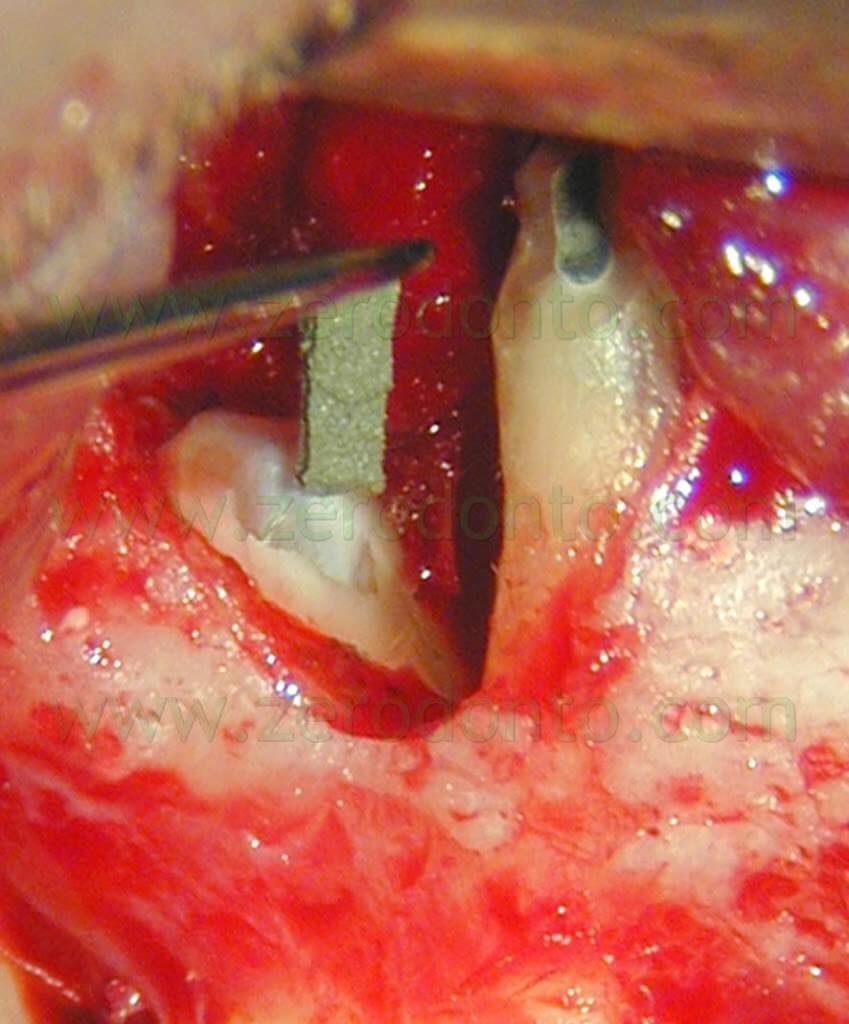
Nell’anno 2000 un altro carrier specificatamente disegnato per la chirurgia è stato proposto dal Dr. Edward Lee,7 (Figg. 42, 43).

Recentemente un altro carrier è stato disegnato e prodotto dalla Produits Dentaires SA (Svizzera) in collaborazione con il Dr. Bernd Ilgenstein,5 chiamato MAP (Micro Apical Placement) System (Fig. 44)

e questo può essere considerato un carrier “universale” in quanto provvisto di particolari aghi che garantiscono un suo facile utilizzo sia in endodonzia clinica che chirurgica e in chirurgia consente un facile posizionamento dell’MTA anche nei settori posteriori.
Lo strumento
Il MAP System consiste in un applicatore in acciaio con innesto a baionetta (Fig. 45)

per l’inserimento di varie cannule applicatrici (aghi). Gli aghi diritti e leggermente curvi sono disegnati per essere utilizzati in endodonzia ortograda (Fig. 46),

mentre quelli con angolatura tripla (Fig. 47),

sviluppati in collaborazione con il Dr. Bernd Ilgenstein, e quelli con angolatura singola (Fig. 48)

sono particolarmente indicati per l’endodonzia chirurgica.
Gli aghi da chirurgia sono disponibili in due varianti, per essere utilizzati rispettivamente nei quadranti di destra o di sinistra, ognuno con due diametri esterni, 0,9 mm (giallo) e 11 mm (rosso). Il diametro interno degli aghi è di 0,6 mm (giallo) e 0,8 (rosso) per consentire un corretto posizionamento di sufficienti quantità di materiale nelle cavità retrograde.
Il materiale da otturazione può essere raccolto da un piccolo dispenser (Fig. 49).

Il pistone all’interno degli aghi angolati è fatto di un materiale particolare flessibile chiamato PEEK (Polyether Ether-Kethone), un polimero utilizzato per scopi medici (Fig. 50),

mentre il pistone degli aghi dritti o curvi sono costruiti in NiTi (Fig. 51).

I residui di materiale possono essere facilmente rimossi dall’interno degli aghi mediante le apposite curette (Fig. 52 a,b).


E’ ben risaputo che da quando sono entrate in uso le punte da ultrasuoni per la preparazione della cavità retrograda, la superficie radicolare non viene più tagliata con un bisello di 45° ma quasi con un angolo di 90° (Fig. 19b). Questo porta come conseguenza alla necessità di avere un carrier particolare capace di depositare il materiale da otturazione retrograda lavorando con un angolo di 90° (Figg. 53a-e).

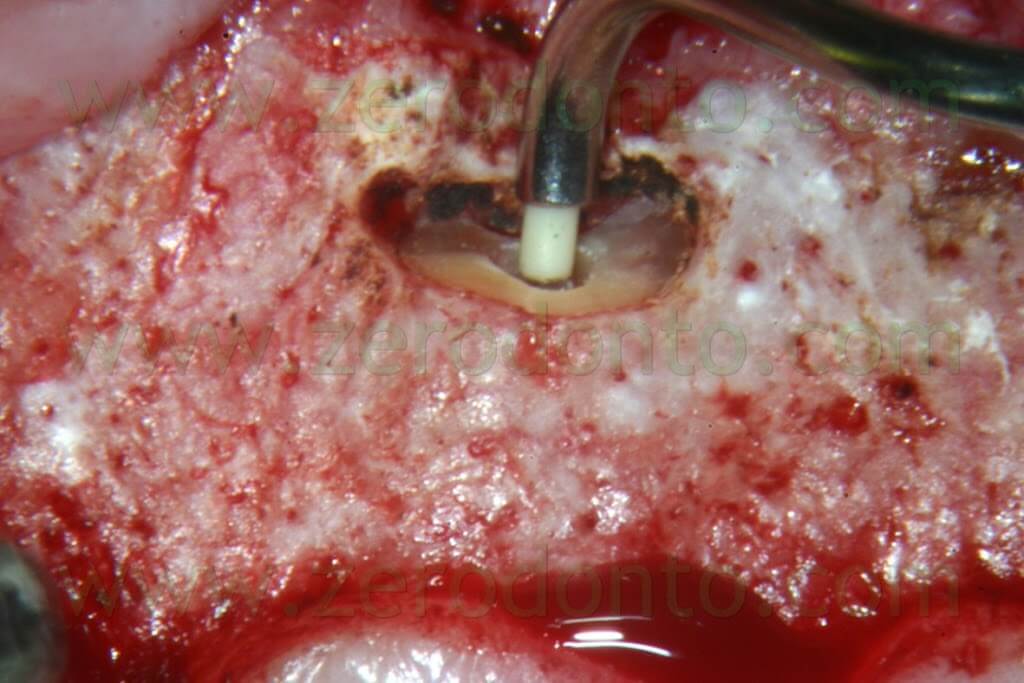
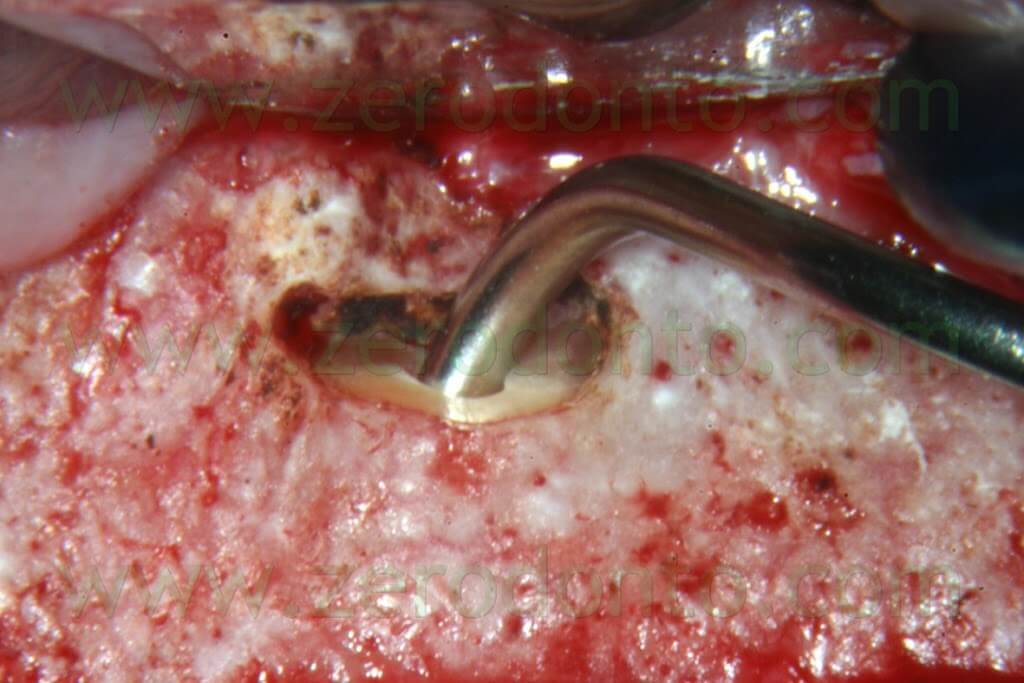
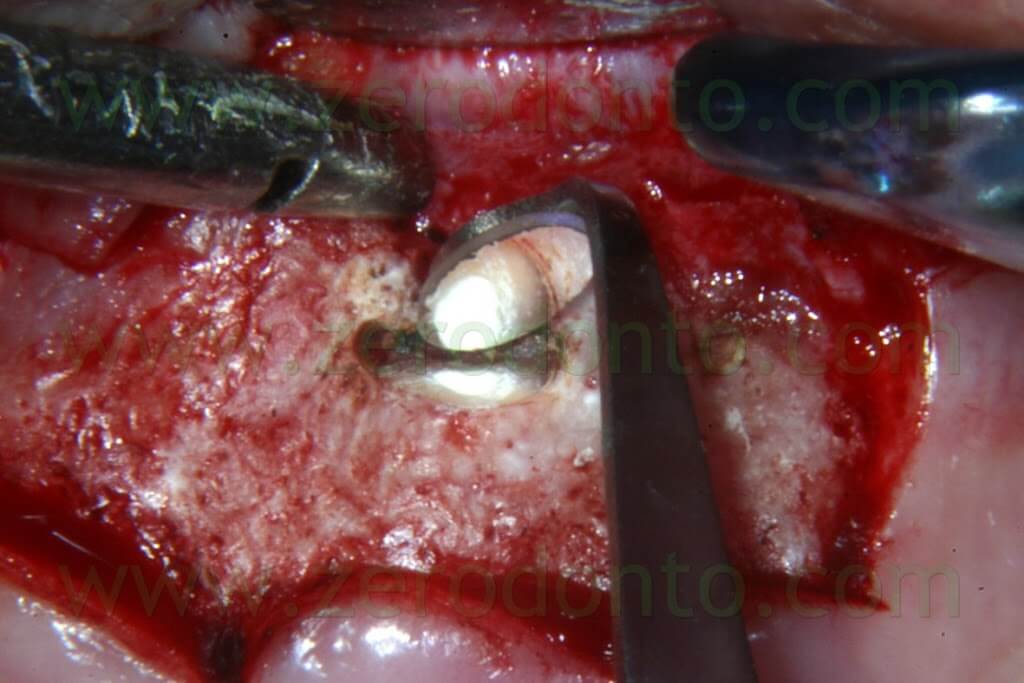
Per questo scopo, il MAP System è il carrier ideale in quanto è fornito con numerosi aghi di diverse misure e con diverse angolazioni.
Gli aghi con angolatura singola sono particolarmente indicati per i denti anteriori, mentre quelli con angolatura tripla trovano la loro indicazione nei denti dei settori posteriori. Sono disponibili in due varianti, con angolazione a destra e a sinistra, per facilitare il trattamento delle regioni di difficile accesso (canali palatini di premolari e molari superiori, canali linguali di molari inferiori).
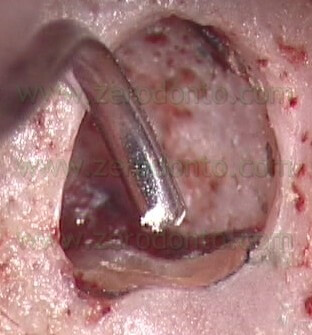
Il pistone all’interno dell’ago è intenzionalmente più lungo dell’ago (Fig. 54),

per cui non solo serve a portare l’MTA nelle cavità retrograde, ma funziona anche come plugger, per cui inizia la compattazione del materiale nelle zone più profonde della cavità retrograda (Fig. 55 a-e).
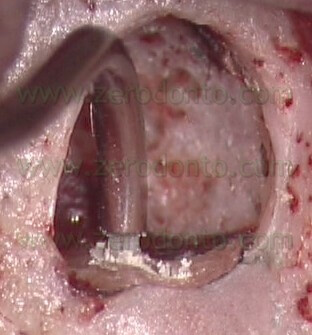
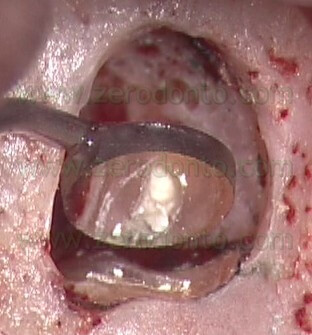
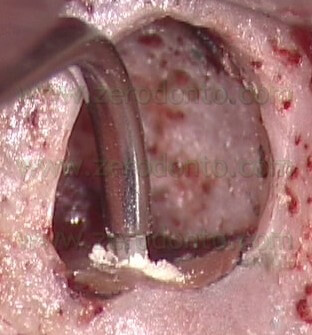
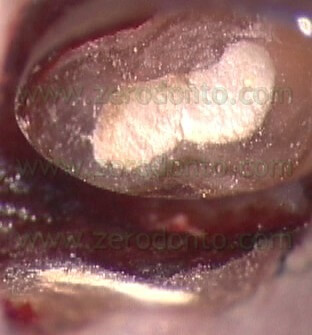
VIDEO
VIDEO
VIDEO
Viene così ad essere eliminato il rischio di incorporare bolle d’aria e il materiale retrogrado risulterà sempre ben compattato.
Un altro vantaggio derivante dall’utilizzo del MAP System in chirurgia consiste nel perfetto controllo del materiale da otturazione che può facilmente essere compattato nella cavità retrograda senza disperderne nell’osso e nei tessuti molli circostanti.
Dal punto di vista operativo, una volta eseguita la cavità retrograda con le punte da ultrasuoni e tenuto sotto controllo il sanguinamento nella breccia ossea, l’operatore chiede all’assistente di miscelare il cemento MTA della giusta consistenza e quindi, dopo che è stato provato nella cavità retrograda per controllare che sia della giusta dimensione, di porgere l’ago carico di materiale. La consistenza dell’MTA deve essere né troppo asciutta né troppo bagnata. Se il materiale è troppo umido, può risultare difficoltosa la sua compattazione nella cavità retrograda. Se al contrario l’MTA è stato miscelato troppo asciutto, risulterà difficile l’estrusione del materiale dall’ago e la siringa facilmente si intaserà. In questo caso, si deve evitare di premere con troppa forza. Il pistone in PEEK non è sufficientemente rigido, si fletterà in prossimità dell’attacco a baionetta e quindi dovrà essere sostituito. Per questo motivo, durante un intervento di chirurgia è sempre consigliabile avere due aghi pronti a portata di mano.
Sutura
L’esecuzione della sutura sotto il microscopio operatorio comporta il vantaggio di una maggiore accuratezza nel riposizionamento del lembo, consentendo una perfetta guarigione per prima intenzione, senza la formazione di alcuna cicatrice. L’autore del presente articolo è in disaccordo con coloro che raccomandano l’utilizzo del microscopio per l’osteotomia, il curettage, l’apicectomia, la preparazione della cavità retrograda, l’otturazione retrograda e la documentazione, ma non per l’incisione del lembo né per la sutura. Suturare sotto il microscopio talvolta può essere difficile, soprattutto nelle regioni posteriori, ma l’accuratezza nel riposizionamento garantita dal microscopio non può essere paragonata con quella fornita dagli occhiali telescopici o peggio ancora dall’occhio nudo!
La sutura ha lo scopo di mantenere i tessuti molli in posizione durante il periodo di guarigione e non deve incoraggiare la colonizzazione batterica. Se il riposizionamento è stato accurato come deve essere, la guarigione avviene per prima intenzione in 24-48 ore e questo è il motivo per cui la sutura deve essere rimossa dopo il medesimo tempo.1 Lasciata in sede per un periodo più lungo, la sutura non ha più alcuna funzione se non quella di trattenere placca e agisce semplicemente come irritante. Presto verrà completamente coperta da batteri e causerà infiammazione e ritardo della guarigione, che avverrà per seconda intenzione.
Molti sono i materiali oggi disponibili in commercio per le suture. La seta non è più raccomandata, in quanto favorisce la colonizzazione batterica. Il nylon è colonizzato più lentamente, ma è troppo rigido e spesso i pazienti si lamentano, in quanto la sutura irrita il labbro o la guancia. La sutura Tevdek è costituita da un nuovo materiale fatto di una fibra intrecciata di poliestere ricoperta di politetrafluoroetilene. E’ molto resistente alla colonizzazione batterica e non è assolutamente irritante. La misura suggerita per la sutura è 6-0 (Figg. 56; Fig. 57 a,b; Fig. 58).

Conclusioni
L’endodonzia chirurgica oggi può essere eseguita con una accuratezza e predicibilità di risultati che non era possibile raggiungere 10 o 15 anni fa. L’ingrandimento e l’illuminazione, insieme ai nuovi strumenti e ai nuovi materiali, garantiscono una percentuale di successo più elevata di quanto non si sia mai avuto fino ad ora (Fig. 59).
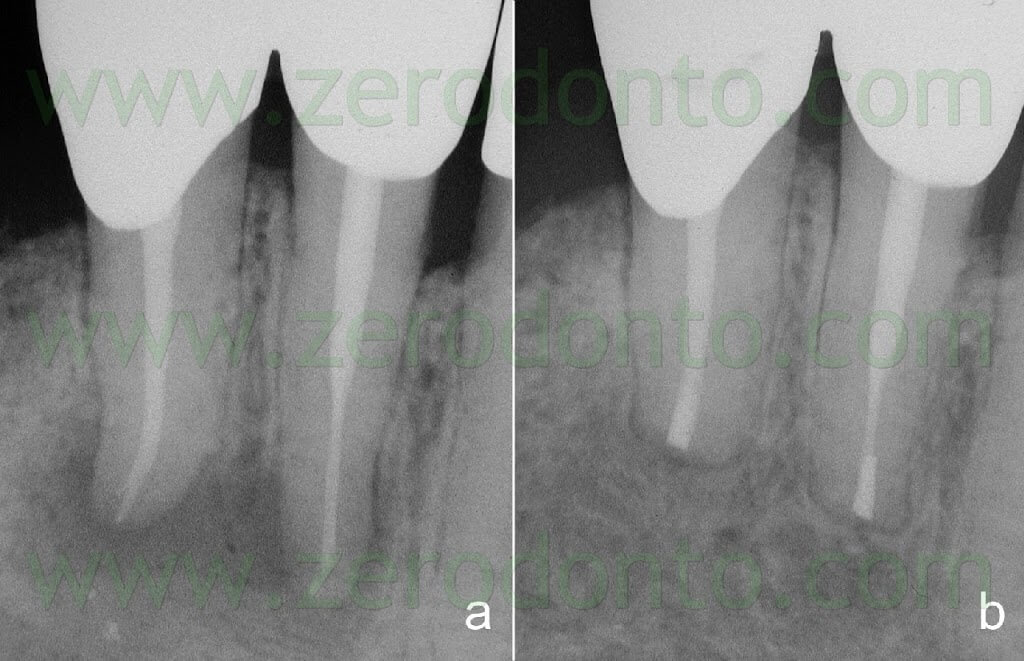
Utilizzando il microscopio, l’incisione è più accurata, il sollevamento del lembo è meno traumatizzante per i tessuti molli, l’osteotomia e l’apicectomia sono più conservative. Utilizzando le punte da ultrasuoni, la preparazione della cavità retrograda è più precisa, perfettamente in asse con il canale radicolare, l’intera sua superficie è più detersa, l’otturazione retrograda è più accurata e l’esatto riposizionamento dei tessuti molli garantisce una guarigione perfetta senza alcuna cicatrice. Per tutti questi motivi, l’intervento chirurgico garantisce oggi dei risultati più predicibili e una percentuale di successo più elevata.
DIDASCALIE
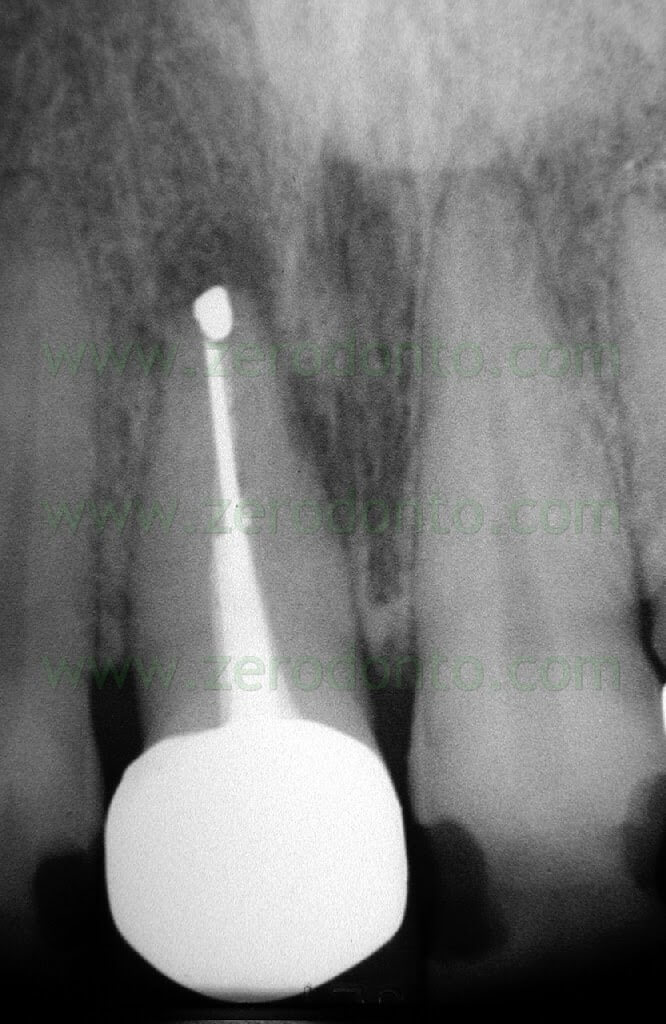
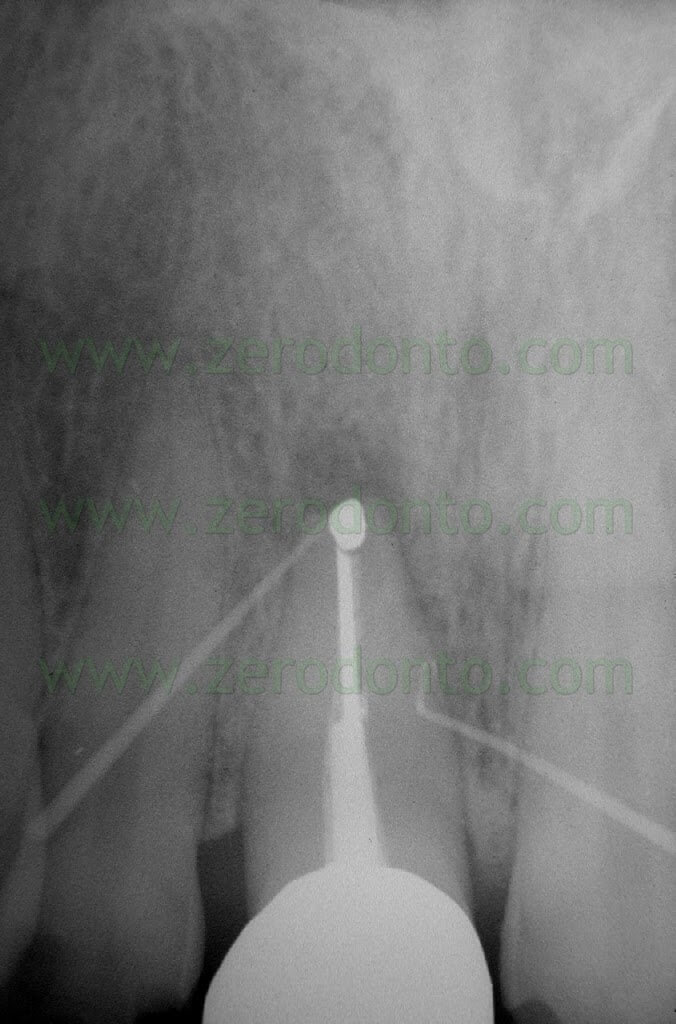
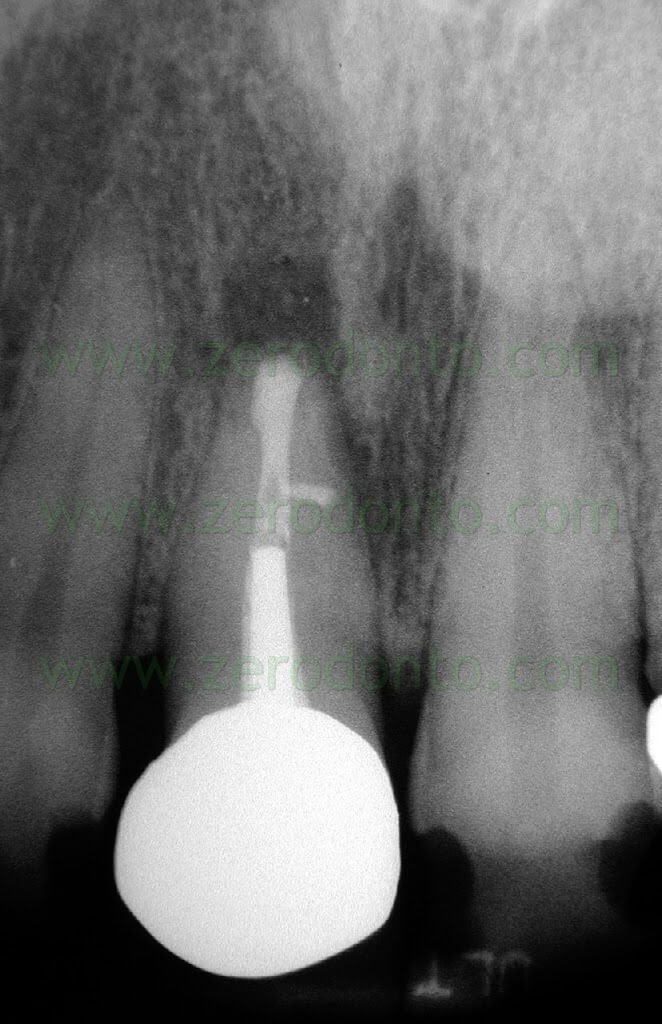
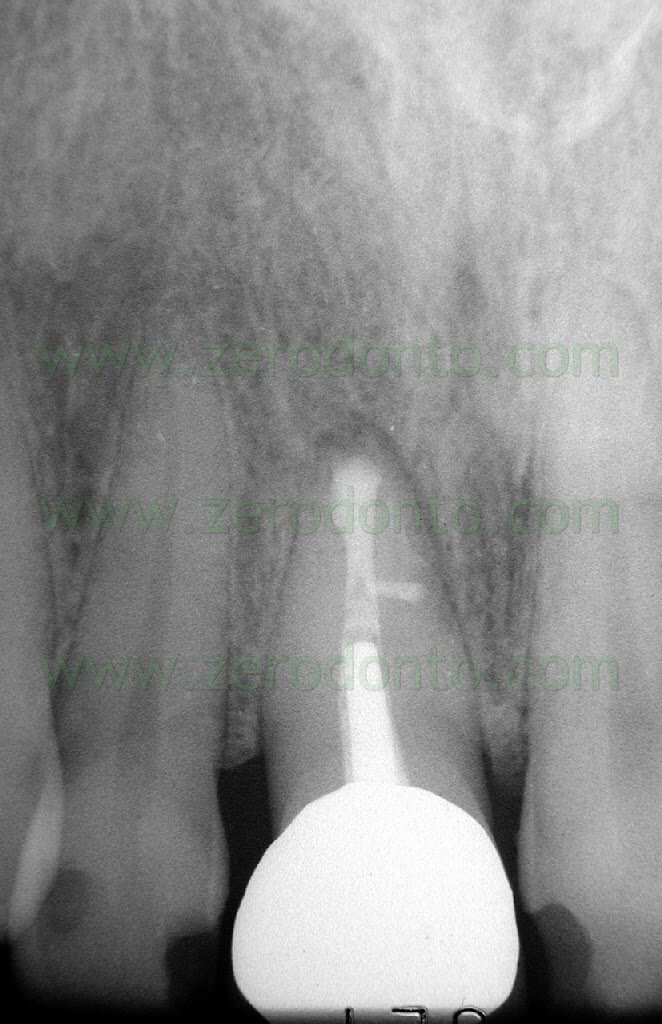
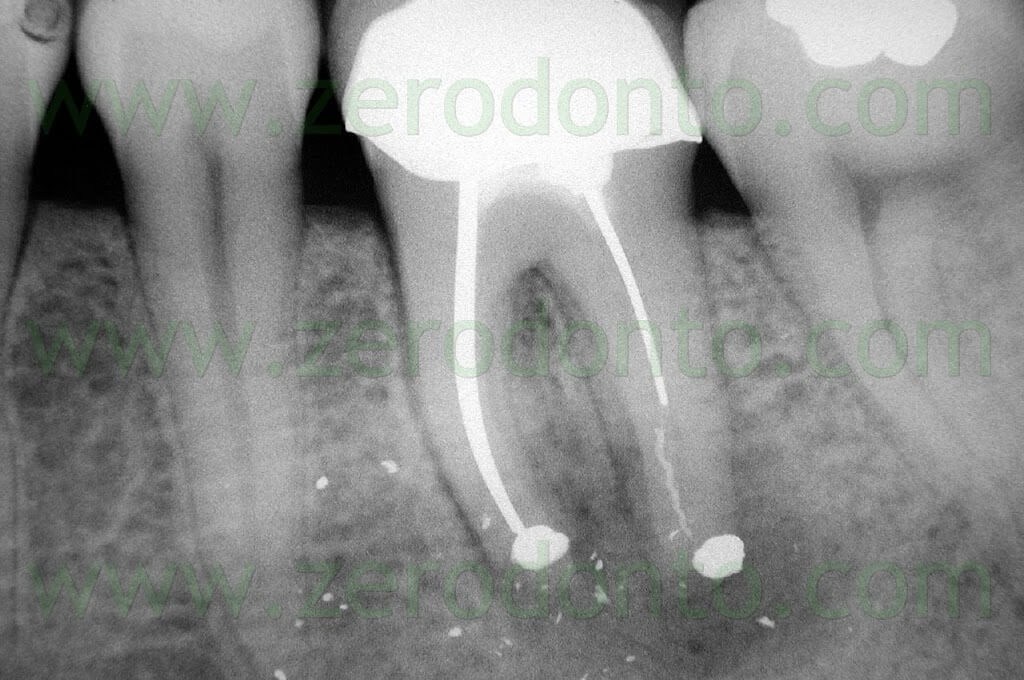
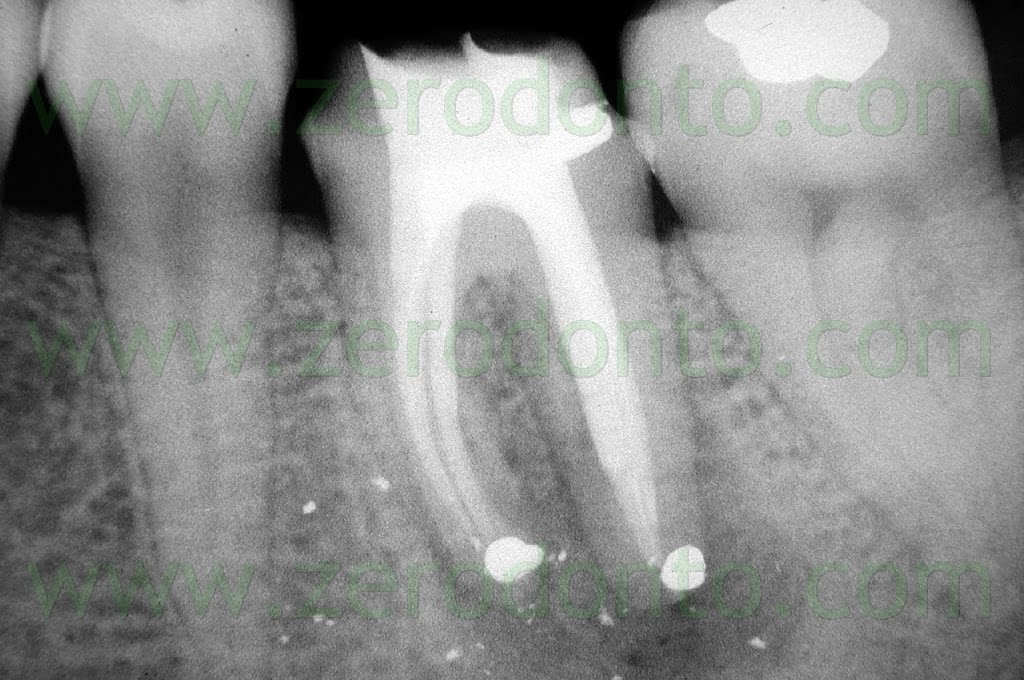
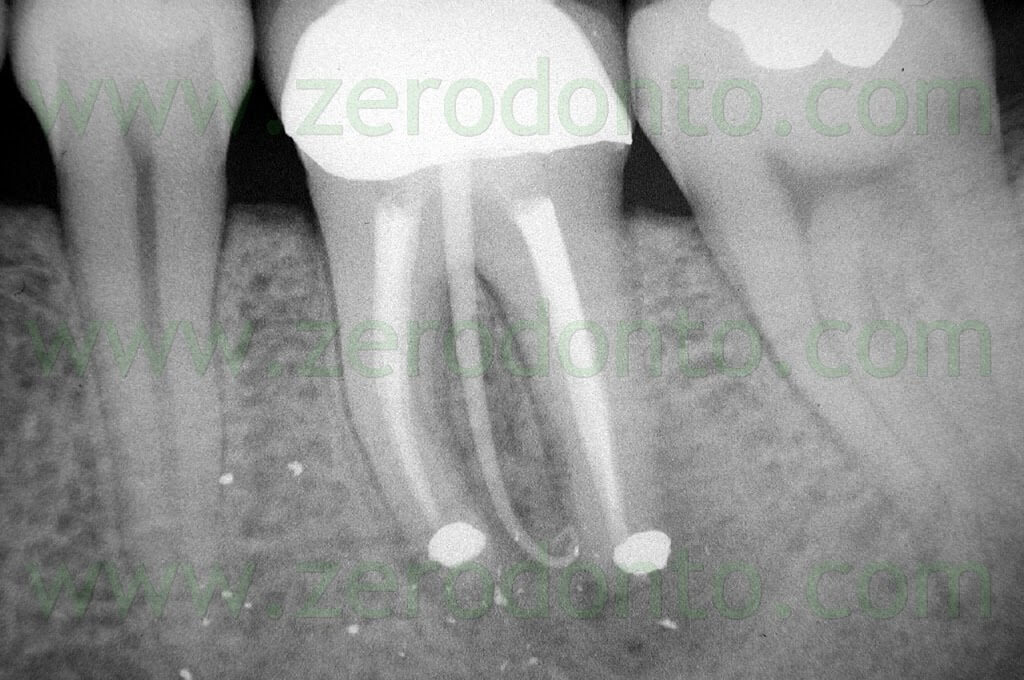
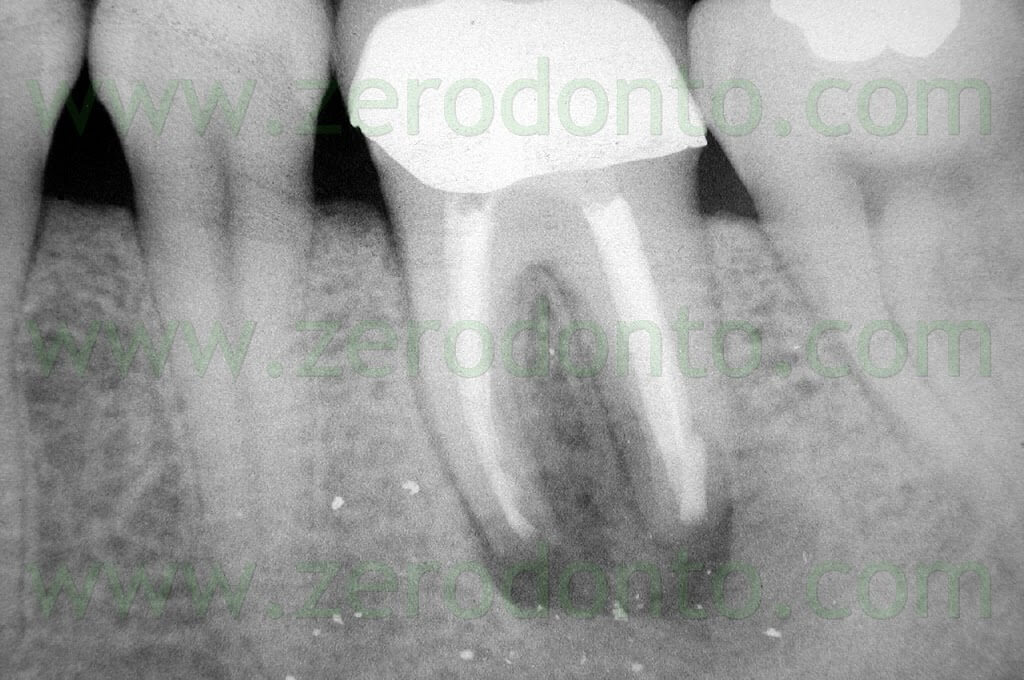
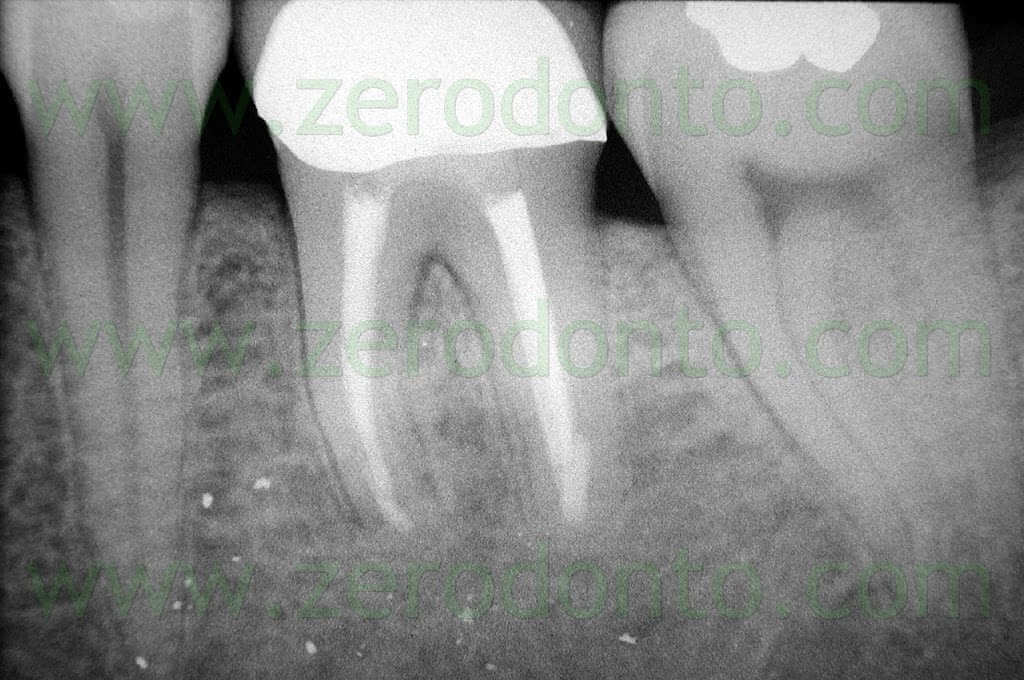
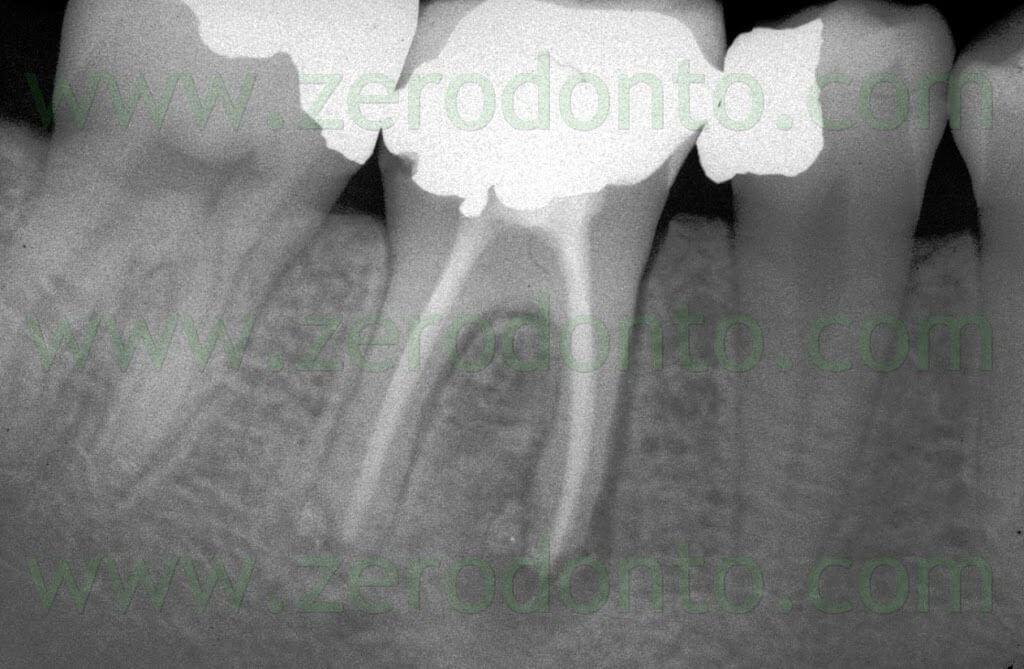
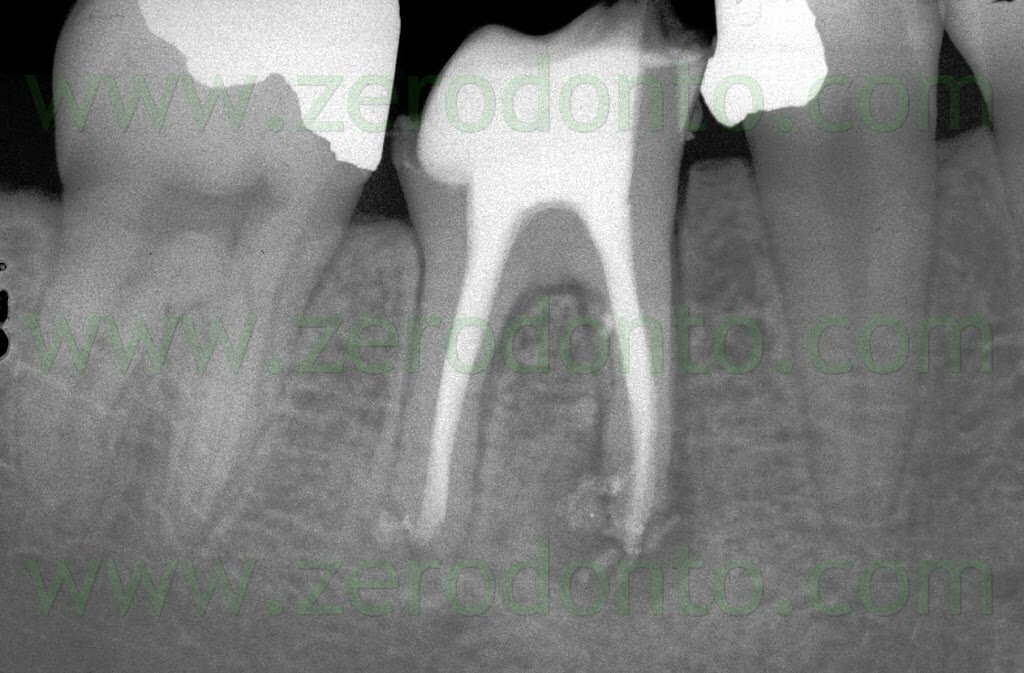
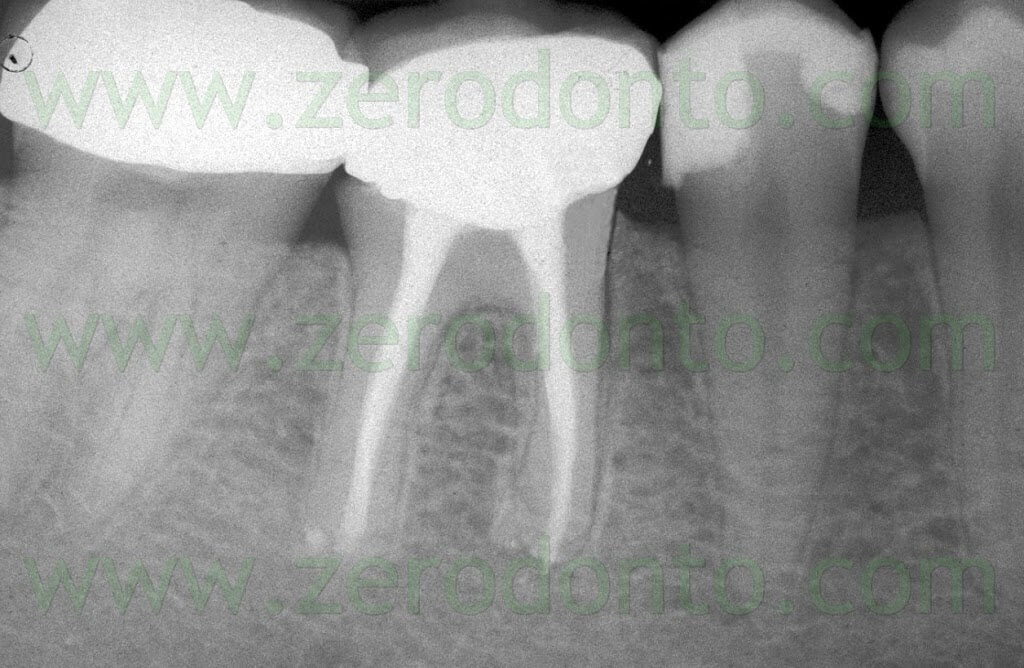
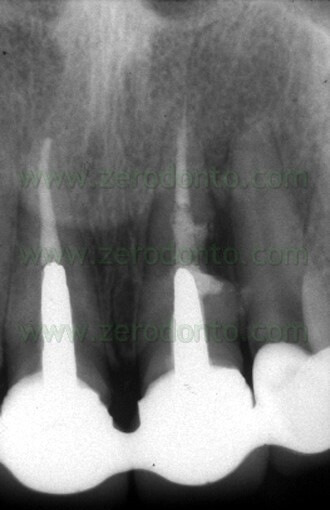
Fig. 1. Un tipico esempio di Endodonzia Chirurgica. A. Radiografia preoperatoria. B. Sono presenti due tragitti fistolosi. C. Radiografia postoperatoria: sono stati ritrattati per via chirurgica sia il canale principale che il canale laterale. D. Radiografia di controllo dopo due anni.
Fig. 2. Un tipico esempio di Chirurgia Endodontica: l’intervento è stato eseguito dopo il fallimento di una terapia ortograda male eseguita. A. Radiografia preoperatoria. B. Radiografia postoperatoria dopo il ritrattamento ortogrado. C. Dopo pochi mesi la paziente si ripresenta con una fistola: ora c’è l’indicazione al ritrattamento chirurgico. D. Radiografia postoperatoria: le otturazioni retrograde sono state eseguite con Super EBA. E. Radiografia di controllo dopo due anni.
Fig. 3. A. Per la presenza di materiale oltre apice e la vicinanza della precedente otturazione canalare alla biforcazione, potrebbe essere indicato il ritrattamento chirurgico. B. E’ stato eseguito il ritrattamento ortogrado che ha evidenziato la presenza di due canali dimenticati, il distolinguale ed il canale mesiale mediano. C. La radiografia di controllo eseguita dopo 5 anni mostra la completa guarigione della lesione e la completa scomparsa del materiale oltre apice, a conferma che il “granuloma da corpo estraneo” è una scusa inventata da chi non vuole e non sa preparare i canali in tutta la loro lunghezza e preferisce restare “corto”.
Fig. 4. Il contrangolo più piccolo è sempre troppo grande se paragonato alle punte da ultrasuoni.
Fig. 5. Immagine al SEM di una preparazione di cavità retrograda eseguita con un fresa. La preparazione non coinvolge il margine vestibolare del canale originale (Per gentile concessioner del Dr. Gary Carr, San Diego)
Fig. 6. A. In alto il canale originale, in basso la cavità retrograda eseguita a spese della porzione palatina del canale originale. B. Il canale originale. C. La cavità fatta dalla fresa. Il video mostra il ritrattamento chirurgico di un incisivo superiore destro nel quale era stata eseguita anni prima un’apicectomia con otturazione retrograda in amalgama. La cavità retrograda era stata eseguita con una fresa a rosetta, lavorando esclusivamente a spese della porzione palatina del canale radicolare.
Fig. 7. Il dente è stato trattato con apicectomia ed otturazione retrograda alcuni anni prima. Le cavità retrograde erano state eseguite con la fresa senza interessare l’istmo. E’ presente una fistola. A. Radiografia preoperatoria con un cono di guttaperca nel tragitto fistoloso. B Si vedono le due amalgame separate. C. Le amalgame sono sstate rimosse e le cavità retrograde sono state unite con la preparazione dell’istmo. D. Radiografia di controllo dopo due anni. E’ evidente la completa guarigione.
Fig. 8. Il microscopio operatorio consente anche una posizione di lavoro più ergonomica.
Fig. 9. A piccolo ingrandimento può essere osservato l’intero campo operatorio.
Fig. 10. Durante l’intervento chirurgico in un quadrante inferiore è necessario localizzare il nervo mentoniero per evitare qualsiasi danno a questa importante struttura anatomica. La foto è stata eseguita attraverso il microscopio.
Fig. 11. La breccia ossea deve essere sufficientemente ampia da consentire l’introduzione delle punte da ultrasuoni.
Fig. 12. L’uso dell’anestetico con vasocostrittore nella concentrazione di 1:50.000 è la condizione necessaria per poter eseguire l’intervento chirurgico.
Fig. 13. Il microbisturi CK2 (Analytic Endodontics) paragonato alla lama Bard-Parker n. 15.
Fig. 14. A-C. Il lembo deve essere scollato sottominandolo in direzione distale e non corono apicale, per non ledere il periostio.
Fig. 15. L’incisione paramarginale deve essere eseguita appoggiando il bisturi con un angolo di 90° ai tessuti sottostanti.
Fig. 16. In alto sono visibile due frese a rosetta da alta velocità di diverso calibro.
Fig. 17. La fresa di Lindemann.
Fig. 18. La turbina Impact Air 45 appositamente studiata per l’uso chirurgico e prevenire la formazione di enfisemi nei tessuti molli circostanti.
Fig. 19. A, B. La resezione apicale viene eseguita con un taglio della radice quasi a 90°.
Fig. 20. Il blu di metilene viene utilizzato per evidenziare una frattura radicolare a partenza apicale.
Fig. 21. A-C. La frattura verticale apicale è ora evidente.
Fig. 22. Stesso caso della figura precedente. A. Radiografia preoperatoria. Il primo premolare superiore di destra ha uno strumento fratturato nella radice palatina e guttaperca estrusa dalla radice vestibolare. Durante l’intervento chirurgico è risultato evidente il fatto che la guttaperca è stata estrusa attraverso la frattura apicale avvenuta durante l’otturazione eseguita con condensazione laterale. B. Radiografia post-operatoria. C. Radiografia di controllo dopo due anni. Se la frattura può essere eliminata dalla fresa che esegue il taglio della radice, la prognosi rimane ottima.
Fig. 23. A. Il solfato ferrico con l’apposita siringa per il suo utilizzo nella breccia ossea. B. Particolare della siringa che all’estremità ha un piccolo pennello per “pennellare” delicatamente la zona sanguinante.
Fig. 24. Le punte da ultrasuoni standard disegnate da Gary Carr. Da sinistra a destra: CT 1, CT 5, Back Action Tip.
Fig. 25. Le piccole punte SLIM JIM n. 1 e n. 5.
Fig. 26. La Back Action Tip è particolarmente indicata nella preparazione della cavità retrograda di radici con inclinazione linguale molto pronunciata, come nell’incisivo laterale superiore della foto.
Fig. 27. A. Le punte da ultrasuoni Pro Ultra disegnate da Cliff Ruddle. B. Si noti la porta per l’irrigazione molto vicina all’estremità lavorante.
Fig. 28. Le punte disegnate da Elio Berutti con il rivestimento di diamante (EMS).
Fig. 29. Le punte BK3 disegnate da Bertrand Khayat (Analytic Endodontics) con tre curvature appositamente costruite per lavorare con facilità nei settori posteriori.
Fig. 30. La punta da ultrasuoni va posizionata inattiva e deve essere attivata solo successivamente.
Fig. 31. Visione stereo-microscopica della cavità retrograda eseguita in un terzo molare estratto. L’istmo è stato incorporato nella preparazione della cavità retrograda col massimo rispetto dell’anatomia canalare.
Fig. 32. A. La mancata preparazione ed otturazione dell’istmo sono state la causa del fallimento di questa terapia. Si noti tra l’altro come le cavità retrograde otturate in amalgama abbiano poco a che fare con la sede originale dei canali. B. Particolare a maggiore ingrandimento. (Per gentile concessione del Dr. Gary Carr, San Diego).
Fig. 33. La preparazione della cavità retrograda eseguita con l’utilizzo delle punte da ultrasuoni deve essere profonda almeno 3 millimetri ed essere in asse con il canale.
Fig. 34. Aspetto della cavità retrograda eseguita nella radice mesio-vestibolare di un primo molare superiore sinistro. Sono stati preparati i due canali della radice e l’istmo che li univa.
Fig. 35. I microscpecchietti di Gary Carr. I più utilizzati sono i due a destra, l’ovale di 3mm x 6 mm e il tondo di 3 mm (http://www.eie2.com/).
Fig. 36. La cavità retrograda viene asciugata con l’irrigatore di Stropko.
Fig. 37. Il sottile cono di Super EBA è aderente all’estremità della piccola spatola e viene così portato all’interno della preparazione apicale.
Fig. 38. Il ProRoot MTA bianco (Dentsply Tulsa Dental, Oklahoma).
Fig. 39. A. Radiografia postoperatoria. B. Controllo dopo due anni. Si noti la perfetta guarigione.
Fig. 40. A. Radiografia preoperatoria. B. Radiografia postoperatoria. C. Controllo dopo due anni. Si noti la perfetta guarigione.
Fig. 41. I carrier disegnati dal Dr. Joseph Dovgan per il posizionamento dell’MTA.
Fig. 42. Il carrier disegnato dal Dr. Edward Lee per il posizionamento dell’MTA.
Fig. 43. Il cilindretto di MTA sta per essere introdotto nella cavità retrograda. (Per gentile concessione del Dr. John Stropko, Phoenix).
Fig. 44. Il Micro Apical Placement (MAP) System.
Fig. 45. L’attacco a baionetta per l’inserimento degli aghi intercambiabili.
Fig. 46. Gli aghi diritti per endodonzia ortograda.
Fig. 47. Gli aghi con angolatura tripla per l’endodonzia chirurgica dei settori posteriori.
Fig. 48. Gli aghi con angolatura singola per l’endodonzia chirurgica dei settori frontali.
Fig. 49. Il dispenser per il riempimento degli aghi con il materiale da otturazione.
Fig. 50. Il pistone degli aghi angolati è fatto di “PEEK”.
Fig. 51. Il pistone degli aghi diritti è fatto di NiTi.
Fig. 52. A. Curette per la pulizia degli aghi di differenti misure. B. La punta della curette a maggiore ingrandimento.
Fig. 53. A-E. Dopo essere stato provato, l’ago sta ora portando il materiale da otturazione nella cavità retrograda.
Fig. 54. Il pistone all’interno dell’ago è costruito intenzionalmente più lungo dell’ago stesso, in modo da agire anche da plugger.
Fig. 55 A-E. Il carrier può iniziare a lavorare anche come plugger, cominciando a compattare il materiale da otturazione nelle porzioni più profonde della cavità preparata.
Fig. 56. La sutura in Tevdek.
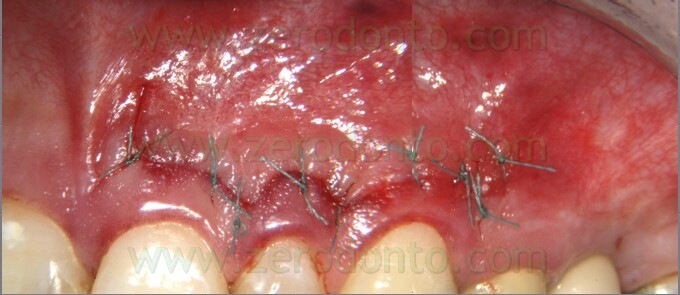
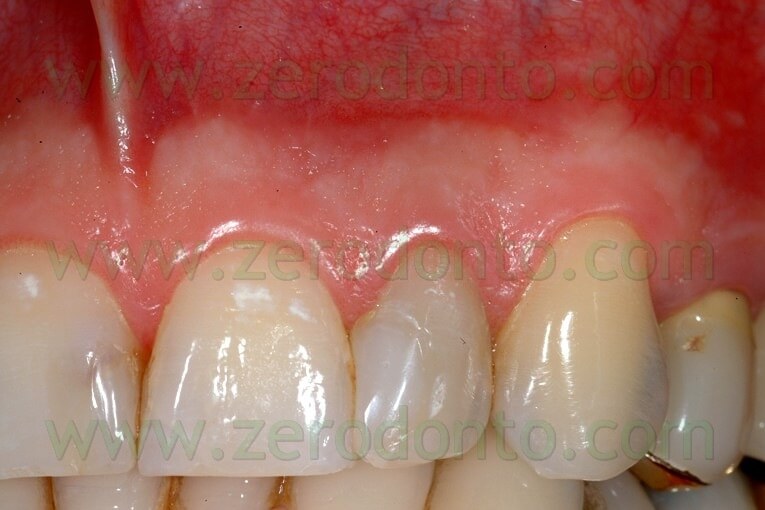
Fig. 57. A. La sutura in Tevdek è stata appena eseguita. B. Perfetta guarigione senza alcuna cicatrice dopo tre mesi. La sutura era stata tolta dopo 24 ore.
Fig. 58. Altro caso in cui la paziente si è potuta presentare in studio per la rimozione della sutura solo una settimana dopo l’intervento. Si noti la quasi assoluta mancanza di placca batterica sulla sutura.
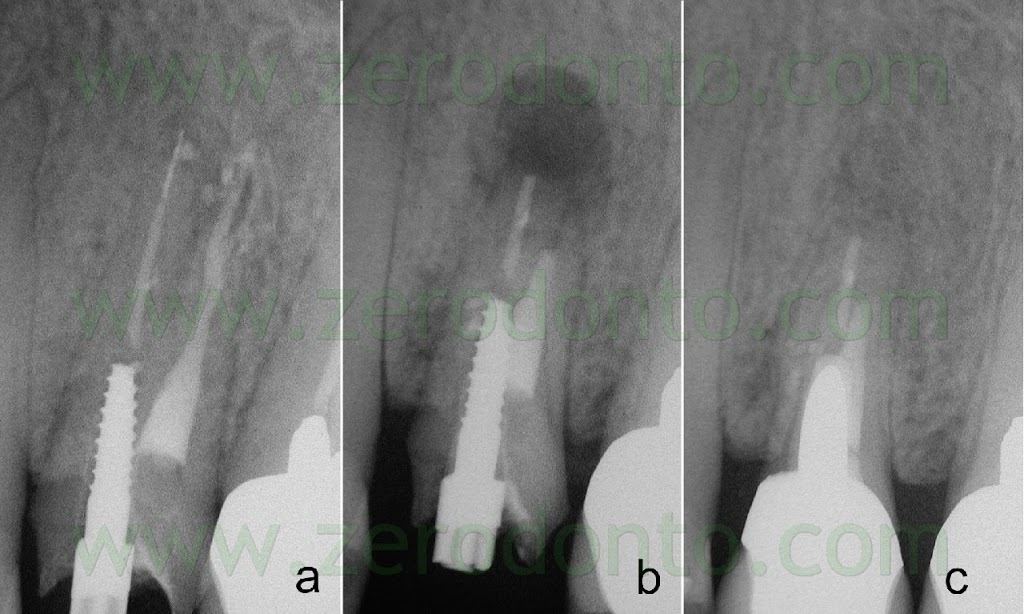
Fig. 59. A. radiografia preoperatoria. B. Radiografia di controllo dopo due anni. Si notino le otturazioni retrograde profonde 3 mm, in asse con il canale radicolare e delle medesime dimensioni dei canali radicolari originali.
Bibliografia
1. Carr, G.B., Bentkover, S.K.: Surgical Endodontics. In: Cohen S. and Burns R.C. Eds. Pathways of the Pulp 7th ed. St. Louis, USA: Mosby, 1998: 608-656.
2. Carr, G.B.: Microscopes in Endodontics. Calif. Dent. Assoc. J. 11:55-61, 1992.
3. Carr, G.B.: Ultrasonic Root End Preparation. In: Kim S. ed. The Dental Clinics of North America. Microscopes in Endodontics. Philadelphia, USA. W.B. Saunders Company Vol. 41, N° 3, July 1997: 541-554.
4. Frank, A.L. et al.: Long-term evaluation of surgically placed amalgam fillings. J. Endod. 18:391-398, 1992.
5. Ilgenstein, B., Jager, K.: Micro Apical Placement System (MAPS). A new instrument for retrograde root canal filling. Schweiz Monatsschr Zahnmed, Vol. 116: 1243-1252, 12/2006.
6. Kim S.: Principles of Endodontic Microsurgery. In: Kim S. ed. The Dental Clinics of North America. Microscopes in Endodontics. Philadelphia, USA. W.B. Saunders Company Vol. 41, N° 3, July 1997: 481-498.
7. Lee, E.S.: A new Mineral Trioxide Aggregate root-end filling technique J. Endod. 26:764, 2000.
8. Lemon, R.R., Jeansonne, B.G., Boggs, W.S.: Ferric sulfate hemostasis: effect on osseous wound healing. II. With curettage and irrigant. J. Endod. 19:174-176, 1993.
9. Lemon, R.R., Steele, P.J., Jeansonne, B.G.: Ferric sulfate hemostasis: effect on osseous wound healing. I. Left in situ for maximum exposure. J. Endod. 19:170-173, 1993.
10. Nygaard-Ostby, B., Schilder, H.: Inflammation and infection of the pulp and periapical tissues: a synthesis. Oral Surg. 34:498, 1972.
11. Oynick, J., Oynick, T.: A study of a new material for retrograde fillings. J. Endod. 4:203-206, 1978.
12. Rubinstein, R.A.: The anatomy of the surgical operating microscope and operating positions. In: Kim S. ed. The Dental Clinics of North America. Microscopes in Endodontics. Philadelphia, USA. W.B. Saunders Company Vol. 41, N° 3, July 1997:391-414.
13. Rubinstein, R.A.: Endodontic microsurgery and the surgical operating microscope. Compendium. (18) 7:659-672, 1997.
14. Schwartz, R.S. et al.: Mineral trioxide aggregate: a new material for endodontics. Case reports. J. Am. Dent. Assoc. 130:967-975, 1999.
15. Stropko, J.J.: Apical microsurgery. Endodontic communiqué. Boston University, School of Dental Medicine, Summer 1998, 12-14.
16. Torabinejad, M., Higa, R.K., McKendry, D.J., Pitt Ford, T.R.: Dye leakage of four root end filling materials: effects of blood contamination. J. Endod. 20:159-163, 1994.
17. Torabinejad, M., Hong, C.U., McDonald, F., Pitt Ford, T.R.:Physical and chemical properties of a new root-end filling material. J. Endod. 21:349-353, 1995.
18. Torabinejad, M., Watson, T.F., Pitt Ford, T.R.: Sealing ability of a mineral trioxide aggregate when used as a root end filling material. J. Endod. 19:591-598, 1993.
19.Weine, F.S., Gerstein, H.: Periapical Surgery. In Weine F.S.: Endodontic Therapy. 3a ed. St. Louis. The C.V. Mosby Company
Dr. Arnaldo Castellucci
dal 1980 esercita la professione limitatamente all’Endodonzia.
E’ Past President della S.I.E., Società Italiana di Endodonzia e Past President della I.F.E.A., International Federation of Endodontic Associations, della quale è stato Presidente nel triennio 1993-95. E’ Socio Attivo della A.A.E., American Association of Endodontists, dell’A.I.O.M., Accademia Italiana di Odontoiatria Microscopica e della E.S.E., European Society of Endodontology, della quale è stato segretario nel biennio 1982-83.
E’ Professore a Contratto presso il Corso di Laurea in Odontoiatria dell’Università di Firenze.
E’ fondatore del Centro per l’insegnamento della Micro-Endodonzia, con sede in Firenze, dove insegna e tiene corsi teorico-pratici su argomenti di Endodonzia Clinicae Chirurgica al Microscopio.
Contatti: castellucci@dada.it
Per Informazioni:
zerodonto@gmail.com

