L’obiettivo della terapia endodontica è quello di rimuovere l’infezione e di eradicare i batteri dal sistema dei canali radicolari (Sjogren U, Fidgor D, Persson S, Sundqvist G. Influence of infection at the time of root filling on the outcome of endodontic treatment of teeth with periapical periodontitits Int. End. J 1997; 30(5): 297-306).
La strumentazione è, da sola, insufficiente ad eradicare la carica batterica (Bystrom A, Sundqvist G. Bacteriologic evaluation of the efficacy of mechanical root canal instrumentation in endodontic therapy. Scan J Dent Res 1981; 89(4): 321-8).
Questi risultati sono stati confermati anche da successivi lavori, come quello di Dalton et Al. (Dalton BC et Al. bacterial reduction with nickel-titanium rotary instrumentation. J Endod 1998; 24(11): 763-7) che ha rilevato come non vi siano differenze significative nella detersione quando si utilizzano strumenti rotanti o manuali.
Nella fase della strumentazione l’azione principale degli irriganti è quello di rimuovere i detriti dal canale ed è proprio la sinergia tra strumentazione ed irrigazione a causare una significativa diminuizione nel numero di batteri all’interno del canale (Siqueira JF, et al. Mechanical reduction of the bacterial population in the root canal by three instrumentation techniques. J Endod 1999; 25(5): 332-5)).
Come evidenziato da Radcliffe (Radcliffe CE et Al: Antimicrobial activity of varying concentrations of sodium hypochlorite on the endodontic microrganisms Actinomices Israelii, A. naeslundii Candida Albicans and Enterococcus Faecalis Int. Endod. J 2004; 37: 438-46) l’azione dell’ipoclorito di sodio è resa ardua dalla complessità anatomica dell’endodonto (fig 1), dalla natura polimicrobica della flora batterica (fig 2), dalla presenza di biofilm (fig 3) e dalla presenza di smear layer (fig 4) prodotto dai nostri strumenti.


Inoltre l’ambiente endodontico risulta essere particolarmente ostile nei confronti degli irriganti.
Haapasalo e Colleghi (Haapasalo M, Qian W, Portenier I, Waltimo T. Effects of Dentin on the antimicrobial properties of endodontic medicaments. J Endodon 2007; 33(8): 917-925) hanno evidenziato quali siano le interazioni degli irriganti e delle medicazioni intermedie utilizzati in vivo.
Il collagene, l’idrossiapatite, le proteine sieriche e la dentina possono esercitare un’azione fortemente inibente sull’azione delle svariate sostanze utilizzate nella detersione del sistema canalare. La dentina, ad esempio, ha un effetto tampone sia sulle sostanze acide sia su quelle basiche.
L’ipoclorito di sodio non è in grado di eliminare alcuna carica batterica, dopo un’ora di incubazione, se l’irrigante è stato preincubato con polvere di dentina 24 ore prima dell’utilizzo.
Altre sostanze, quali quelle organiche, possono interferire con l’azione degli irriganti. Il 20% della biomassa della dentina è costituita da Collagene di tipo I, a cui si vanno ad aggiungere resti di tessuto pulpare necrotico e l’essudato infiammatorio che si può raccogliere nel canale entrando dai diversi forami.
Un altro aspetto, legato alla diminuizione dell’azione dei disinfettanti è legato al loro stesso meccanismo d’azione. Per rimuovere la carica batterica è necessario il contatto tra la parete batterica e l’irrigante.
Dunque, la dinamica dell’azione prevede, da una parte, la riduzione della carica batterica ma contemporaneamente una progressiva inattivazione delle sostanze utilizzate. Inoltre, è costante un decremento dei risultati passando dalla sperimentazione in vitro da quella in vivo. Le ragione di questo sono molteplici (Haapasalo M. et Al. 2007): oltre ai già citati meccanismi di inattivazione dei farmaci all’interno dei canali, gli irriganti hanno un ridotto tempo di esposizione e un ridotto volume totale, ovvero solo una modestissima quantità di irrigante giunge a contatto con i batteri e per un tempo sempre troppo limitato.
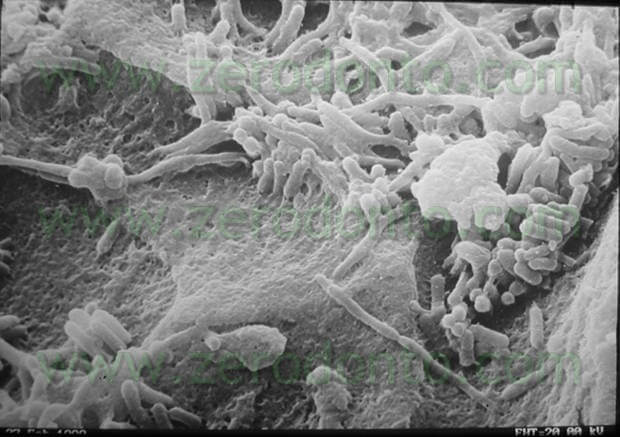
All’interno dei nostri canali la maggior parte dei batteri si trova legata in una struttura fortemente organizzata, il biofilm (fig 5,6), che è in grado di opporsi con vari meccanismi all’azione di rimozione.

I batteri nel biofilm si trovano immersi in una matrice, detta glicocalice, che funge da barriera meccanica nei confronti degli agenti antibatterici. Durante la proprio evoluzione, il biofilm rilascia batteri che vanno ad infettare, in forma planctonica, lo spazio circostante.
Il biofilm risulta più resistente all’azione di antibiotici quali la doxiciclina, l’amoxiciclina e il metronidazolo. Risultato finale di tutte queste azioni è che il biofilm risulta essere 1000 volte più resistente rispetto ai batteri in forma planctonica (Svensater G, Bergenholtz G. Biofilms in endodontics infections. Endodontic Topics 2004; 9: 27-36).
Nel 2003 Torabinejad propose l’uso di un irrigante universale che, utilizzato con Ipoclorito di Sodio alla concentrazione di 1,3%, fosse in grado di rimuovere il fango dentinale dalle pareti canalari (Torabinejad M et Al A new solution for the removal of smear layer. J Endod 2003; 29: 170-5) e di facilitare l’eliminazione dell’Enterococcus Faecalis dalla dentina infetta (Shabahang S, Torabinejad M. Effects of MTAD on Enterococcus Faecalis –contaminated root canals of extracted human teeth. J Endod 2003; 29: 576-9).
Questo irrigante è una miscela di Doxiciclina (un antibiotico del gruppo delle tetracicline), Acido Citrico e di un tensioattivo (Tweed 80). L’acido citrico agisce come chelante , coadiuvato in questo da una debole azione dell’antibiotico, mentre il tensioattivo ne dovrebbe favorire la penetrazione all’interno del sistema canalare.
Nonostante una lunga serie di articoli promossi dal gruppo di Torabinejad ne sottolineassero l’efficienza, altri articoli hanno evidenziato importanti limiti.
Tay e Colleghi (Tay et Al Ultrastructure of smear layer – covered intraradicular dentin after irrigation with BioPure MTAD J. Endod 2006; 32(3): 218-21) hanno evidenziato come il composto sia troppo aggressivo sulla dentina intertubulare, causando una marcata riduzione della matrice collagene esposta.
Ruff e Colleghi ne evidenziarono la assoluta inefficacia contro i funghi (Ruff ML, McClanahan SB, Babel BS. In vitro antifungal efficacy of four irrigants as a final rinse. J Endod 2006; 32(4): 331-3) mentre Dunavant (Dunavant TR et Al. Comparative evaluation of endodontic irrigants against Enterococcus Faecalis biofilms. J Endodon 2006; 32(6): 527-31) ha rilevato come l’azione dell’Ipoclorito di Sodio fosse più efficace nell’eliminare il biofilm mentre Clegg e Colleghi (Clegg MS et Al. The effects of exposure to irrigants solution on apical dentin biofilm in vitro. J Endodon 2006; 32(5): 434-7) hanno evidenziato l’incapacità di questo prodotto di rimuovere il biofilm dal terzo apicale .
Uno studio eseguito su modello di biofilm pubblicato da Giardino e Colleghi (Giardino L, Ambu E, Rimondini R, Savoldi E, Cassanelli C, Debbia EA Comparative evaluation of antimicrobial efficacy of Sodium Hypochlorite, MTAD and Tetraclean against Enterococcus faecalis biofilm. J Endodon 2007; 33(7): 852-5) ha confermato la scarsissima azione dell’MTAD su questa struttura (fig 7) .

Nel 2004 Luciano Giardino, ha brevettato un prototipo di irrigante, sempre a base antibiotica, che è stato chiamato Tetraclean. Simile all’MTAD, se ne differenzia per alcuni aspetti importanti:
· la quantità di doxiciclina è ridotta ad un terzo (50mg/5ml contro i 150mg/5ml dell’MTAD)
· Polipropilenglicole
· Acido citrico e cetrimide.
Le ricerche di validazione sull’efficacia del prodotto sono state condotte in collaborazione con l’Università di Genova, con il gruppo dell’Università di Modena-Reggio Emilia, con il Dr Emanuele Ambu Titolare dell’Insegnamento di Endodonzia presso la stessa Università ed il suo Gruppo, i Proff Mario e Renato Leonardo e la Dott.ssa Fernanda Pappen dell’Università di Araraquara Sao Paulo Brazil , il Prof M. Haapasalo Dean della British Columbia University, I Proff. Sandro Rengo, P. Ausiello, A. Valletta, F. Riccitiello, M. Amato, M. Simeone, i Dr F.A. D’Apolito, G. Spagnuolo, V. D’Antò, C. D’Ambrosio, P. Carratù del Dipartimento di Scienze Odontostomatologiche e Maxillo-Facciali, Reparto di Endodonzia, Università di Napoli “Federico II”.
La ricerca di base ha permesso di verificare che il Tetraclean è attivo, in agar, su batteri responsabili dell’infezione endodontica primaria come la Prevotella Intermedia ed il Porphyiromonas Gingivalis (fig 8,9) (L. Giardino, E. Ambu, R. Rimondini, E.A. Debbia Antimicrobial effect of MTAD, Tetraclean, Cloreximid and Sodium Hypochlorite on three common endodontic pathogens. IJDR 2009 in press) e sull’Enterococcus Faecalis causando un’area di inibizione maggiore di quella dell’Ipoclorito di Sodio (Giardino L, Ambu E, Generali L, Savoldi E. Effetto antimicrobico di due nuovi irriganti nei confronti dell’Enterococcus faecalis: studio comparativo in vitro. G It Endo 2006; 20(2); 91-94).
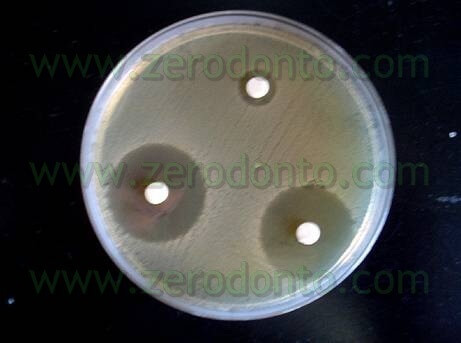
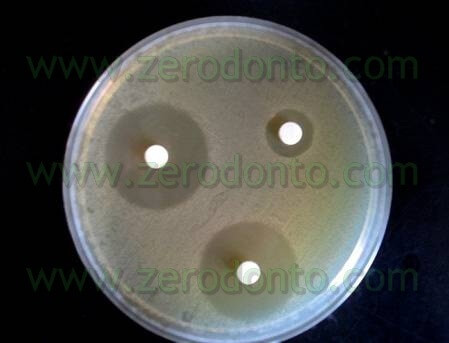
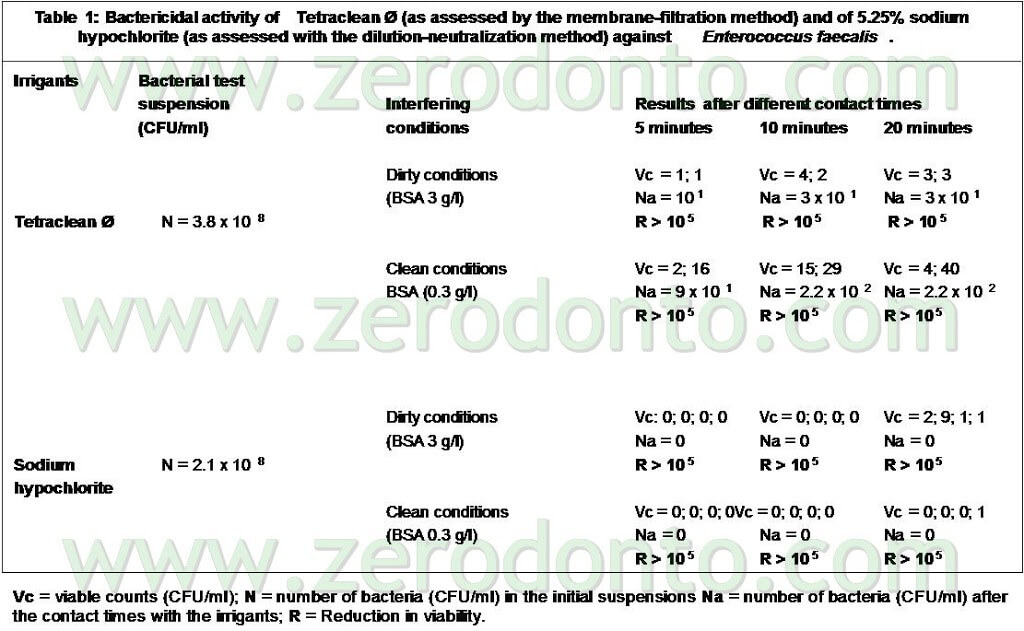
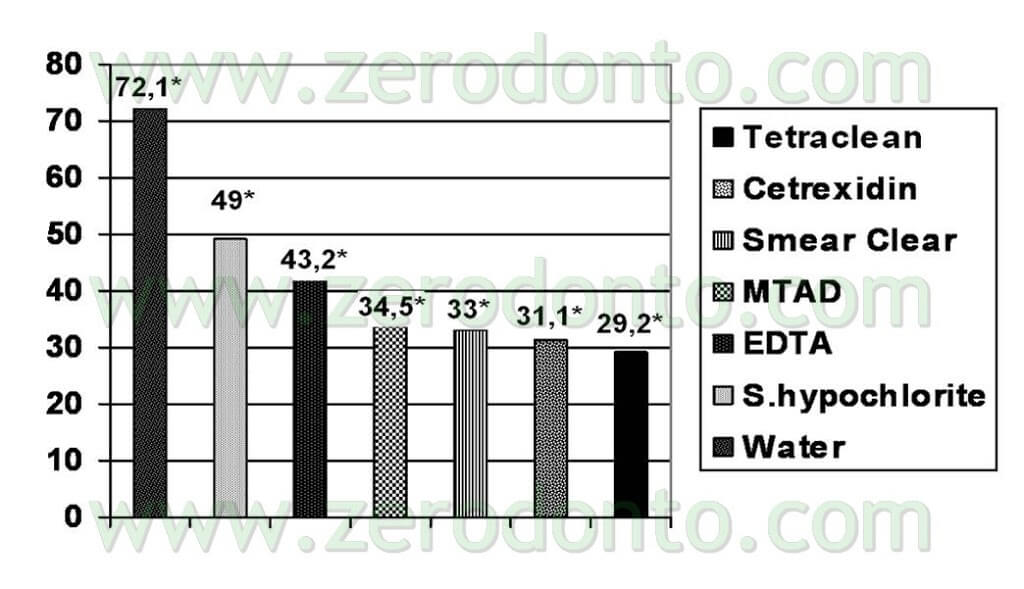
Le prove sono state eseguite anche in condizioni “di sporco” (Tab 1) ed anche in questo caso il Tetraclean ha superato i test di validazione europei (Test di valutazione dell’attività battericida Metodo diluizione-neutralizzazione EN 1276 – 1997) (Neglia R, et Al. Comparative in vitro and ex vivo studies on the bactericidal activity of Tetraclean, a new generation endodontic irrigant, and sodium hypochlorite. New Microbiologica: 2008; 31, 57-65).
La ricerca avanzata ci ha permesso di evidenziare come il Tetraclean sia in grado di eliminare il biofilm in 60 minuti, e che dopo 5 minuti ((fig 10) , la riduzione sia stata del 90% (Giardino L, Ambu E, Rimondini R, Savoldi E, Cassanelli C, Debbia EA Comparative evaluation of antimicrobial efficacy of Sodium Hypochlorite, MTAD and Tetraclean against Enterococcus faecalis biofilm. J Endodon 2007; 33(7): 852-5).

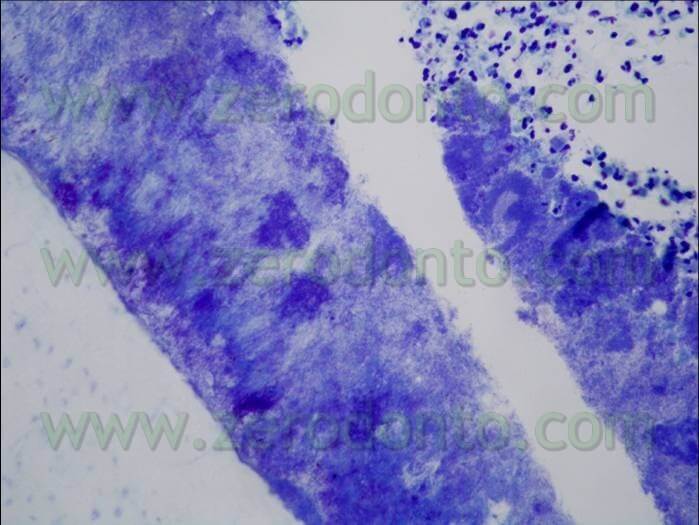
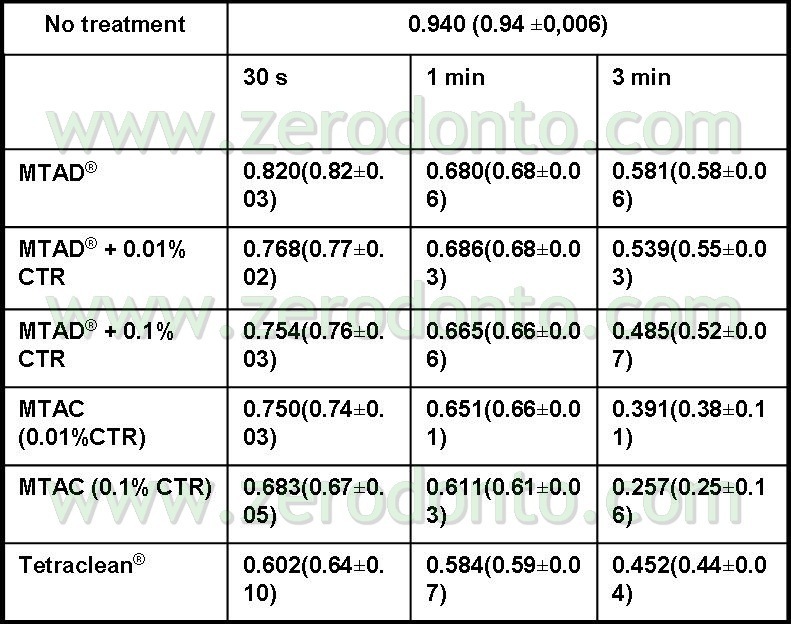
Questi risultati sono stati confermati dal gruppo di Haapasalo (Pappen FG, Shen Y, Qian W, Leonardo MR,Giardino L, Haapasalo M . In vitro Antibacterial Action of Tetraclean, MTAD and formula modifications: direct exposure test and effect on the biofilm. Submitted to Int Endod J 2009). Campioni di biofilm dentali erano incubati in condizioni anaerobiche su dischi di idrossiapatite. Dopo incubazione di 14 giorni, i biofilms erano esposti alle soluzioni irriganti per 30 secondi, 1 minuto e 3 minuti. Era usata la colorazione Live/Dead Baclight stain (Molecular Probes, Europe BV) per differenziare le cellule vive (Verdi da quelle morte (Rosse) ((fig 11,12).
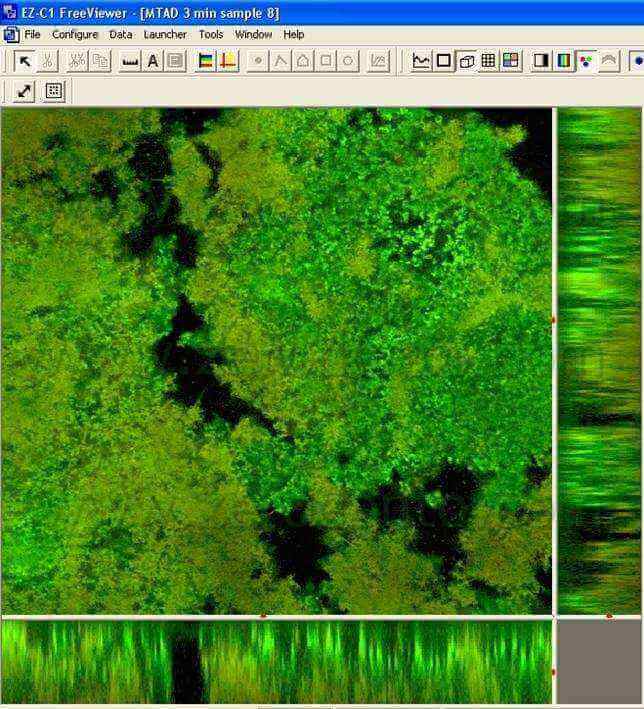
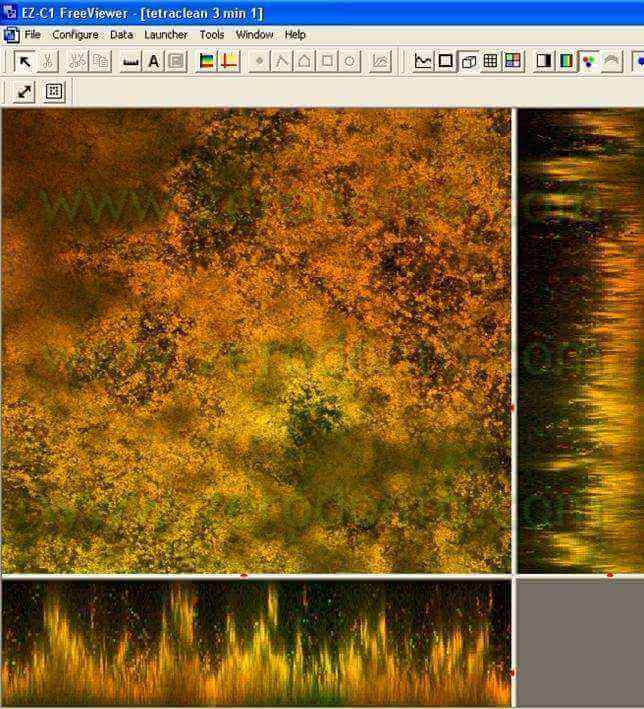
I campioni erano osservati al Microscopio Confocale Laser. Le immagini dei biofilm in 3D erano trasferiti per un’analisi quantitativa al software Imaris 5.0 per il calcolo della percentuale delle cellule verdi vive. A 3 minuti la percentuale di cellule batteriche vive esposte al Tetraclean era pari a o,44 più basso rispetto a MTAD (Tab 2)
Il passaggio successivo è stato quello di osservare il comportamento nel tempo dell’irrigante contro l’enterococcus faecalis in un modello “ex vivo”, cioè su dente estratto. Anche in questo caso si è comparata l’azione del Tetraclean con quella dell’Ipoclorito di Sodio e del brodo di coltura. (Neglia R, et Al. Comparative in vitro and ex vivo studies on the bactericidal activity of Tetraclean, a new generation endodontic irrigant, and sodium hypochlorite. New Microbiologica: 2008; 31, 57-65).
I campioni sono stati contaminati con E. Faecalis con la metodica “overnight” e quindi sono stati irrigati. Prelievi e semine ad intervalli di tempo definiti hanno permesso di valutare il comportamento degli irriganti nelle 144 ore successive.
Come possiamo vedere dalla Tabella 3, la semplice azione meccanica del lavaggio con il brodo è in grado di ridurre di quasi 4 logaritmi la carica batterica, che, ovviamente va poi ristabilizzandosi ai livelli massimi dopo 24 ore, a causa dell’assenza di qualsiasi azione antibatterica di questo “irrigante”.
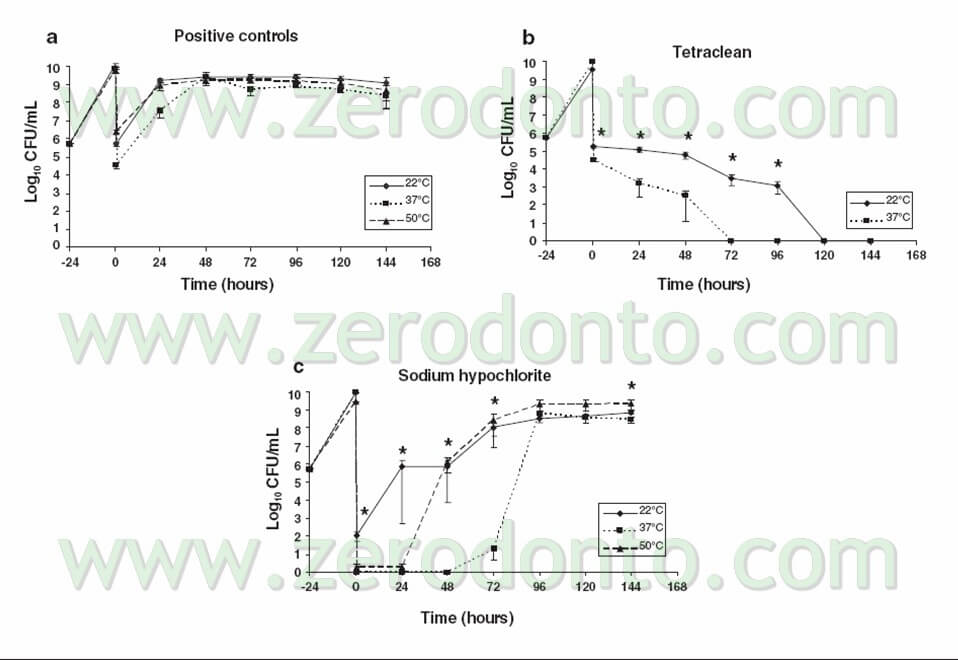
L’ipoclorito di sodio, invece, riduce a zero la carica batterica immediatamente dopo il lavaggio. Questo conferma quanto segnalato già in precedenza, cioè che questo irrigante è l’unico in grado di eliminare completamente la carica di superficie, organizzata in biofilm.
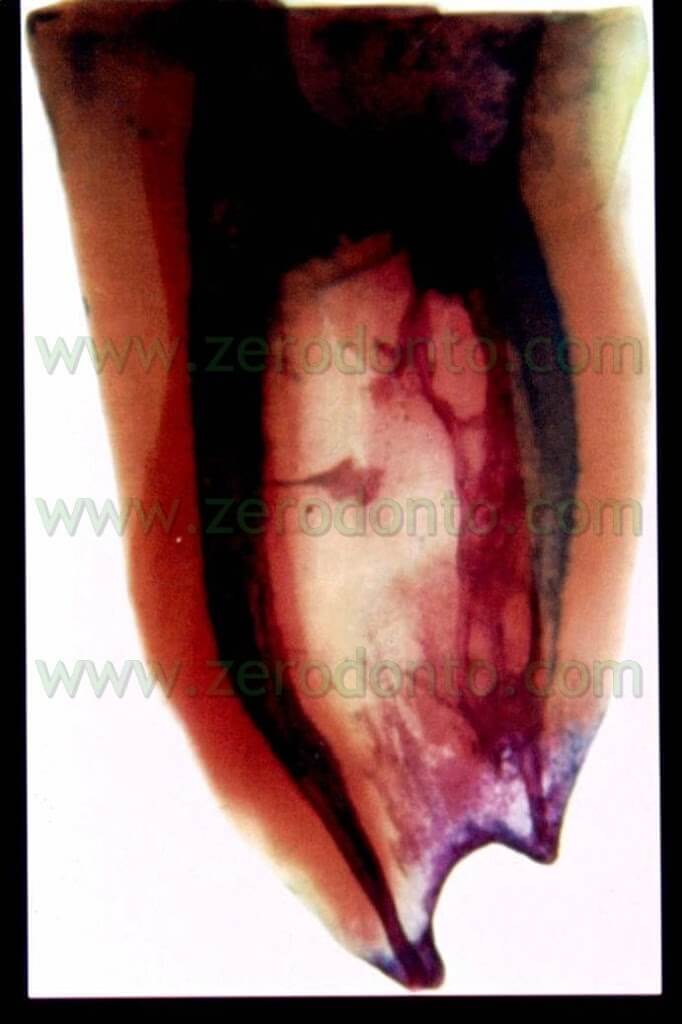
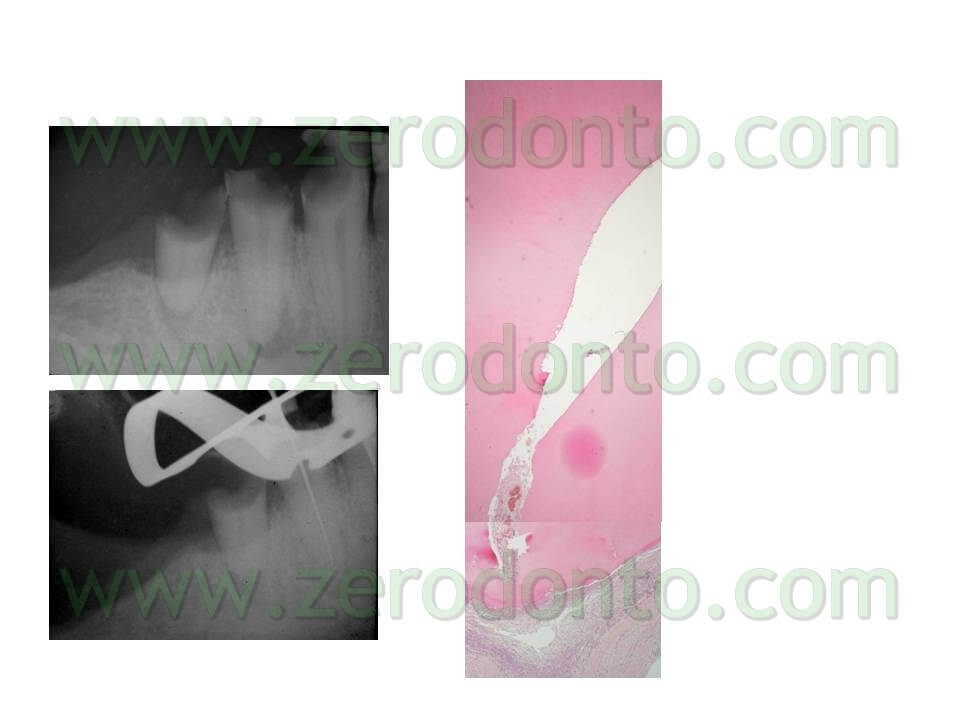
Purtroppo, però, nelle 96 ore successive la carica ricomincia a salire, fino a tornare ai livelli di infezione pre-trattamento, almeno nel 70% dei campioni esaminati. Questi dati sono confermati anche in vivo come dimostrato da questo caso clinico (fig 13 – 13bis).

Viceversa, il Tetraclean pare non avere azione dopo il lavaggio (dove il suo comportamento è simile a quello del brodo di coltura), ma agisce progressivamente nelle 72 ore successive fino ad eliminare completamente la carica batterica nella totalità dei campioni esaminati.
Le ipotesi su questo comportamento sono legate in parte all’azione batteriostatica della doxiciclina ed in parte alla sua substantività, si lega cioè prontamente alla dentina essendone successivamente rilasciata senza perdere la sua attività antibatterica; questa proprietà crea una riserva di agente antibatterico attivo,che viene rilasciato dalla superfice dentinale in maniera lenta e sostenuta.
Tuttavia il problema appare essere più complesso. In fase speculativa, abbiamo ipotizzato che il comportamento dell’ipoclorito di sodio sia abbastanza lineare: l’azione antibatterica è potentissima perché elimina totalmente la carica batterica sulla superficie del canale.
Tuttavia, data la difficoltà a penetrare nei tubuli, come mostrato da Elio Berutti e Colleghi (Berutti E, Marini R, Angeretti A. Penetration ability of different irrigants into dentinal tubules. J Endodon 1997, 23(12), 725-7), l’ipoclorito di sodio non è in grado di raggiungere le zone profonde del sistema canalare e quindi queste rappresentano dei serbatoi dai quali partirà la ricontaminazione del sistema canalare.
Il Tetraclean, probabilmente, è in grado di penetrare queste strutture e di esplicare la propria azione nel tempo, eliminando i ceppi in formazione.
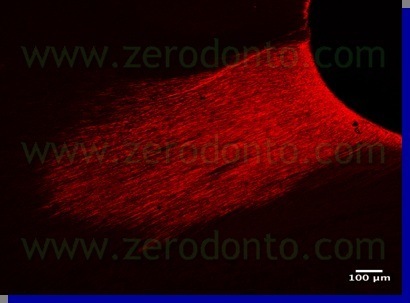
Per confermare questa ipotesi è stato eseguito un altro lavoro, i cui risultati preliminari sono stati presentati al Congresso SIE del 2007 a Napoli da Ambu e Giardino mentre i risultati definitivi, attualmente in corso di pubblicazione, sono stati illustrati in anteprima al Congresso Nazionale SIE di Torino nel Novembre 2008. In questo lavoro si è indagato sulla penetrazione tubulare dell’Ipoclorito di Sodio alla concentrazione del 5,25% e del Tetraclean, marcando gli irriganti ed osservando i campioni con il microscopio ottico polarizzato e con il microscopio a laser confocale. I risultati di questa esperienza confermano che il Tetraclean è in grado di penetrare in profondità nei tubuli dentinali( 6-700µ) (fig 14,15 ) mentre l’azione dell’ipoclorito è solitamente confinato alla superficie canalare (fig 16 ).

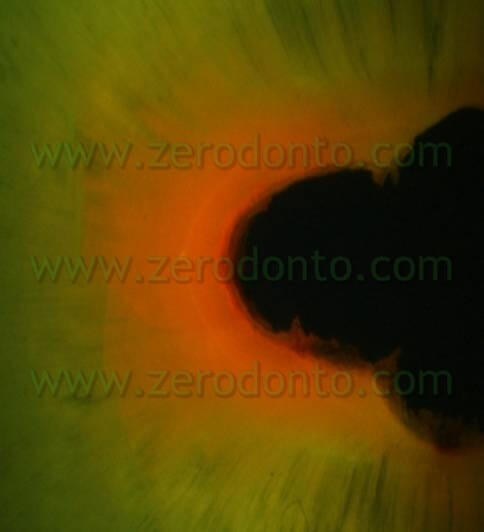
La maggiore penetrazione tubulare è dovuta anche ad una bassa tensione superficiale del Tetraclean rispetto agli altri irriganti testati (Giardino L, Ambu E, Becce C, Rimondini L, Morra S. Surface tension comparison of four common root canal irrigants and two new irrigants containing antibiotics. J Endodo 2006; 32(11): 1091-3) (Tab 4).
In uno studio in vitro, 10 denti monocanalari sono stati strumentati all’apice con files manuali Protaper fino al file F2 irrigando i canali con 2cc di ipoclorito tra uno strumento e l’altro ed alla fine della preparazione i canali sono stati irrigati con Tetraclean per 4 minuti.
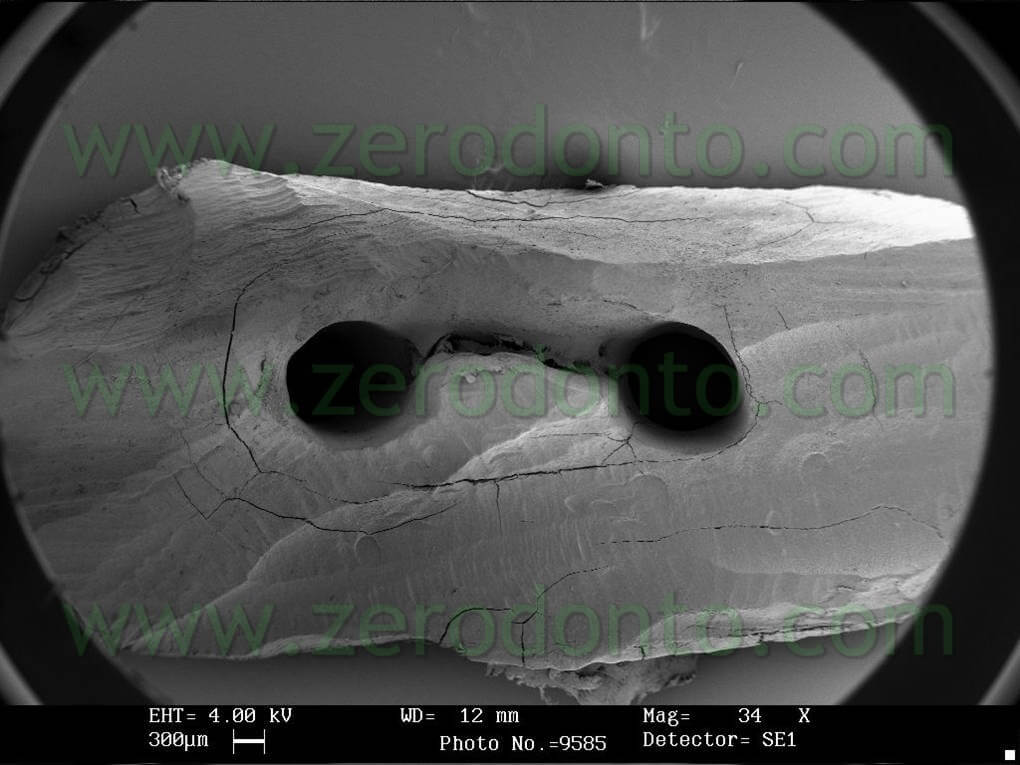
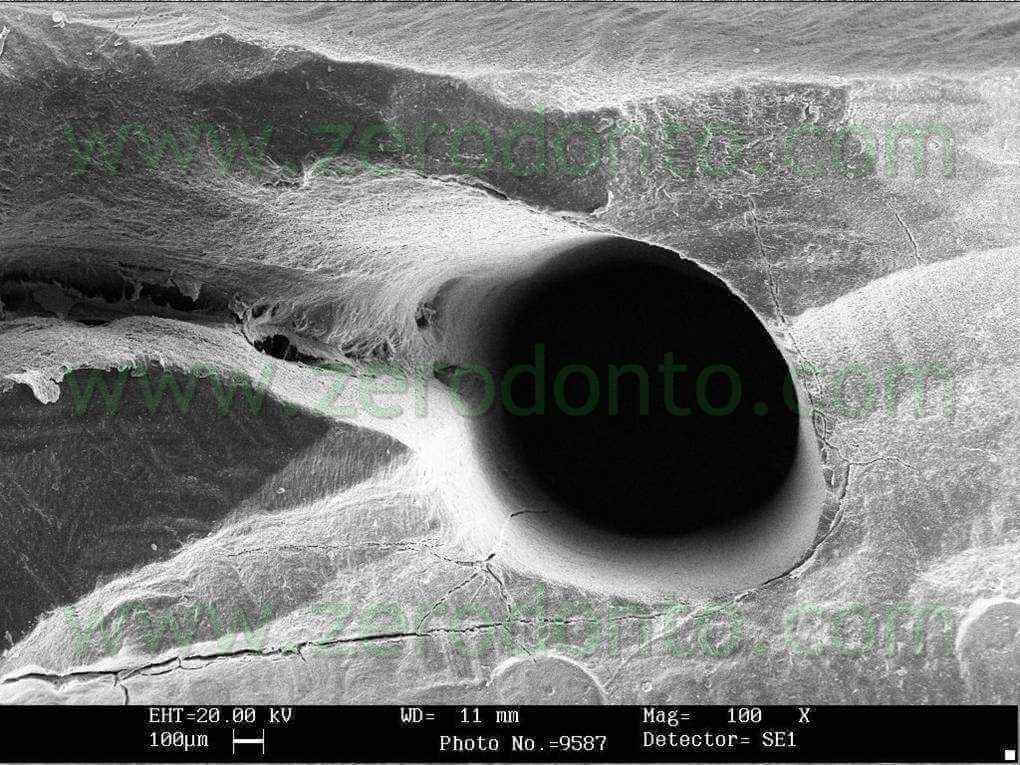
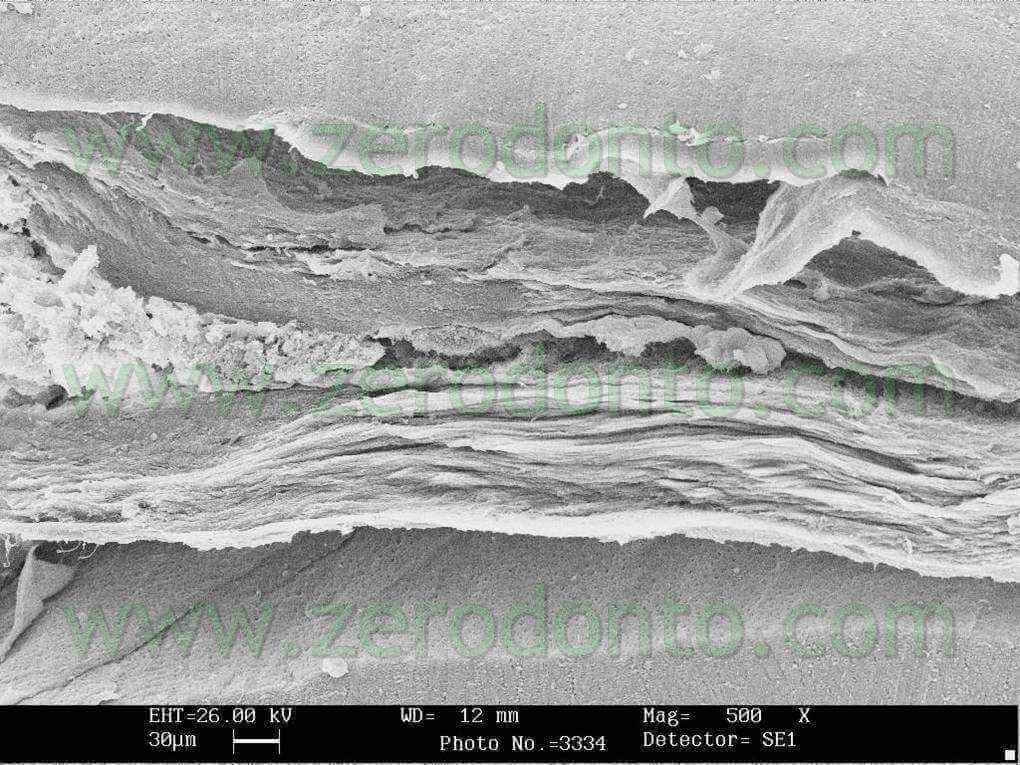
I denti sono stati poi divisi in 2 per frattura ed esaminati al SEM per verificare il grado di pulizia nel terzo coronale medio ed apicale. I risultati confermano un buon grado di detersione a tutti i livelli di esame (fig 17-21) .





L’azione detergente del Tetraclean è stata valutata al SEM (fig 22-24) ed istologicamente (fig 25,26) anche negli istmi dei molari inferiori mediante attivazione ultrasonica passiva finale dell’irrigante per 30 secondi nei canali radicolari.
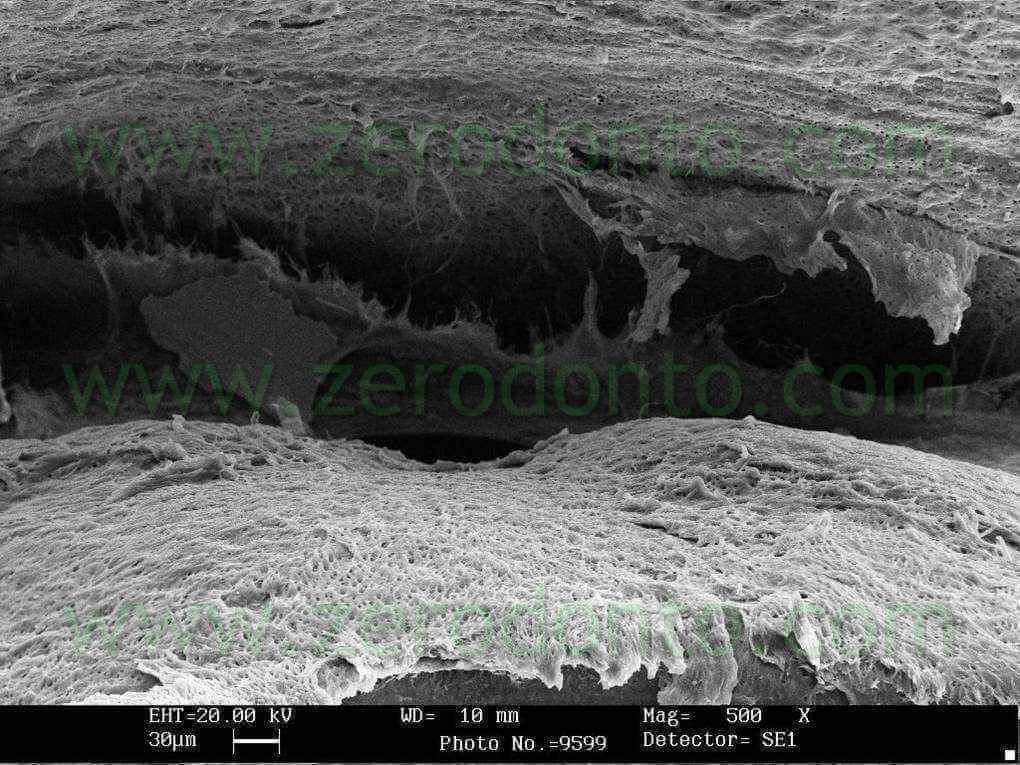


L’attivazione ultrasonica passiva consente una detersione efficace anche in realtà anatomiche normalmente difficili da raggiungere con i soli strumenti canalari (fig 27,28).

La efficacia e la sicurezza clinica del Tetraclean è stata valutata in due studi microbiologici e clinici.
Nel reparto di Endodonzia dell’Università di Modena-Reggio Emilia diretta dal Dr Ambu sono stati selezionati 10 pazienti con periodontite apicale cronica e radiotrasparenza periapicale. Dopo isolamento con diga ed apertura della camera pulpare veniva fatto un primo prelievo microbiologico con cono di carta. Ultimata la sagomatura ogni canale veniva irrigato con 5 cc di Tiosolfato per neutralizzare l’azione dell’ipoclorito ed alla fine irrigato con Tetraclean. Asciugato ogni canale era fatto un secondo prelievo microbiologico .
Gli esami microbiologici effettuati presso il Dipartimento di Microbiologia della stessa Università, diretto dalla Prof Blasi, mostravano un abbattimento del 90% della carica microbica totale su tutti i canali trattati (fig 29 ).

I risultati clinici dello studio pilota su 200 pazienti seguiti con controlli periodici per 1 anno condotta dal gruppo del Prof Rengo per il Ministero della Salute suggeriscono che il Tetraclean è clinicamente efficace e sicuro e confermano che i rischi connessi all’utilizzo di questo irrigante sono quasi del tutto assenti.
La terapia endodontica è esclusivamente un trattamento microbiologico. Da quanto detto sopra emerge chiaramente la difficoltà di dare un razionale scientifco alla nostra detersione del sistema canalare.
L’ipoclorito di sodio non funziona sempre sull’Enteroccus Faecalis, ma funziona sui batteri Gram (-) e su quelli dell’infezione primaria. Le medicazioni intermedie come l’idrossido di calcio e la pasta iodoformica sono spesso inutili nella terapia della patologia endodontica post trattamento, perché l’Enterococcus Faecalis, vero protagonista nel 70% di questi casi, sopravvive benissimo anche in loro presenza.
Tuttavia sappiamo, come dimostrato da Nair, che una terapia “in una seduta” lascia infette molte aree che non possono essere raggiunte dagli irriganti e dagli strumenti. Sicuramente ad oggi non esiste un “liquido magico” o “una macchinetta magica” in grado di risolvere i nostri problemi. Esistono protocolli che possono essere utilizzati e proposti
Ne proponiamo uno, che valga in qualche modo da sunto a quanto descritto sopra:
- Irrigare abbondantemente con NaOCl 5,25% durante la strumentazione per rimuovere il fango dentinale mentre si forma.
- Allargare il canale ad almeno una preparazione a conicità .06 e diametro apicale 25 ( oppure sagomare a conicità maggiori)
- Ulilizzare dispositivi (ad esempio gli ultrasuoni o sistemi sonici o dispositivi a ricambio forzato) per favorire la disgregazione del biofilm e la penetrazione più profonda possibile degli irriganti
- Utilizzare EDTA per un minuto al termine della strumentazione per eliminare la parte organica del fango dentinale
- Sostituire quest’ultimo passaggio con l’uso, per 5 minuti, di irriganti a base antibiotica, appena saranno disponibili.
Come ha scritto Gary Doern , professore di Microbiologia dell’Università dello Iowa, i batteri Gram (-) sono comparsi sulla Terra 3,5 miliardi di anni fa, quelli Gram (+) 3,4 miliardi, i funghi 2,7 miliardi e l’Homo Sapiens Sapiens solo 250.000 anni fa. Siamo in epoca antibiotica da appena 70 anni. Se paragonassimo il tempo dalla nascita dei batteri ad oggi con un anno, i batteri sono comparsi il primo secondo del primo di Gennaio e gli uomini alle 23 e 56 del 31 Dicembre. Abbiamo gli antibiotici dalle 23-59-59.5 dell’ultimo dell’anno. Stabilito dunque che sappiamo chi vincerà la guerra, proviamo a vincere qualche battaglia!
Ringrazio vivamente il Dr. Ambu e tutto il suo team per l’apporto altamente scientifico e fraterno profusomi in questi 5 anni.
Si ringrazia il Dr L. Generali ed iL Prof Cavani per le immagini sullo studio della penetrazione al microscopio a fluorescenza e confocale e la dott.ssa C. Rimoldi per il valido contributo nella parte microbiologica oggetto della sua tesi di laurea
Dott. Luciano Giardino
Medico Chirurgo Odontoiatra
Via Marinella, 12
88900 Crotone
Tel/fax 0962 21249
e-mail: lucianogiardino@libero.it
Autore di oltre 70 articoli su riviste nazionali ed internazionali
Professore a contratto confermato CLOPD Cattedra di Parodontologia Università di Brescia aa. 2002-2007, confermato aa. 2007-2008
Titolare Insegnamento Aspetti istopatologici della malattia parodontale Integrativo Parodontologia I MED/28
Professore a contratto CLOPD Cattedra di Endodonzia Università di Torino aa. 2000-2004
Relatore in Congressi nazionali ed esteri su temi di Istologia e Microbiologia endodontica e parodontale
Visiting Scientist Researcher Dept of Endodontology UConn University 1988
Ricercatore ospite Dip. Microbiologia e Virologia Ospedale Cotugno Napoli 1992
Vincitore Premio Garberoglio 2002 e SPE Torino 2002
Socio ordinario SIE, ESE, Active Member IADR e New York Academy of Sciences
Editorial Board Giornale Italiano di Endodonzia
Revisore Indian Journal of Dental Research
Per Informazioni:
zerodonto@gmail.com

