INTRODUZIONE
È ampiamente dimostrato in letteratura, oltre che consolidata esperienza di ogni odontoiatra, che la perdita di un elemento dentario è inesorabilmente legata ad un’alterazione dell’osso alveolare in altezza e spessore, dal momento che il volume e la forma di quest’ultimo sono proprio legati alla presenza dei denti (Schroeder 1986).
Le dinamiche e l’entità di queste alterazioni sono state studiate sia in modelli animali (Cardaropoli et al. 2003; Araujo & Lindhe 2005), sia nell’uomo (Amler et al. 1960; Evian et al. 1982; Devlin & Sloan 2002; Trombelli et al. 2008).
Queste alterazioni variano considerevolmente da soggetto a soggetto (Atwood 1962), ma in generale pongono il clinico di fronte al problema di dover inserire un impianto in una sede priva del sufficiente supporto osseo o, comunque, di dover trovare una soluzione protesica alternativa che risulti soddisfacente anche dal punto di vista estetico nonostante la cresta ridotta.
Come se ciò non bastasse, i tempi di riassorbimento crestale sono più brevi di quelli canonici di inserimento implantare in un sito estrattivo.
Schropp et al. in uno studio del 2003 hanno evidenziato come i 2/3 della riduzione in spessore avvengano proprio nei primi 3 mesi successivi all’estrazione, arrivando nell’arco di 12 mesi ad una riduzione del 50%. Questi dati sono stati confermati da Araujo e Lindhe che nel 2005 hanno pubblicato uno studio su cane. Mettendo a confronto le alterazioni dimensionali della cresta alveolare in seguito ad estrazione di I e II premolari hanno rilevato come, malgrado cambiamenti dimensionali possano osservarsi nell’arco di un anno risultando in un riassorbimento bucco-linguale del 50%, questi avvengano soprattutto nelle prime 8 settimane e si possano distinguere due fasi.
La prima fase, di riassorbimento del bundle bone con formazione di woven bone che si sostanzia in una perdita di altezza della corticale buccale. La seconda fase è rappresentata dal riassorbimento di entrambe le superfici delle due corticali e, dal momento che la corticale vestibolare è più sottile di quella linguale e formata esclusivamente da bundle bone, tale riassorbimento in senso orizzontale si traduce in un riassorbimento in senso verticale.
Botticelli et al. pure confermano questi dati, evidenziando nei primi 4 mesi un riassorbimento orizzontale del 56% e verticale del 30%.
Un fenomeno che tutti questi studi mettono in evidenza è il maggior riassorbimento della corticale buccale, aspetto che risulta quindi determinante nella morfologia della cresta e che influenza notevolmente il successivo inserimento implantare.
Attualmente, pur essendo ben noto il fenomeno del rimodellamento del sito post-estrattivo, non ne sono ancora chiare le cause. Engler-Hamm et al. nel 2011 hanno individuato nel tempo di guarigione, e quindi nelle dimensioni dell’alveolo, fattori determinanti nel rimodellamento dell’alveolo post-estrattivo, dal momento che quest’ultimo si trova ad essere esposto – nel periodo di guarigione – a traumi di vario genere. Per questa ragione, contrariamente a quanto si possa immaginare, nei settori molari, dove l’alveolo è di dimensioni maggiori, è atteso un maggior riassorbimento della cresta ossea. Questi dati erano in realtà già stati osservati da Araujo, che nel 2005 aveva riscontrato un maggior riassorbimento orizzontale della cresta buccale dei molari (più spessa) in confronto a quella dei premolari, dove la corticale vestibolare è invece più sottile.
In questo contesto la socket preservation nasce come procedura atta a impedire o, più propriamente limitare, l’alterazione della cresta ossea post-estrattiva in funzione di una riabilitazione implanto-protesica ottimale (Jung 2009, Arauho e Lindhe 2005, Fickl et al 2008). In particolare viene limitato il processo di riassorbimento del piatto vestibolare, tanto che in uno studio di Fickl del 2008 emerge come la SP riduca in media il riassorbimento vestibolare di circa 0,7-0,8mm)
Ma quali sono le tecniche usate e qual è il razionale alla base?
Per rispondere a questa domanda occorre tenere bene a mente la struttura dell’alveolo.
- Osso basale di sostegno che forma il corpo della mandibola e della mascella.
- Processo alveolare che si sviluppa in funzione degli elementi dentari
- Bundle bone che riveste l’alveolo e si estende coronalmente formando la cresta vestibolare e in cui sono inserite le fibre parodontali (Sharpey’s fibers)
In seguito all’avulsione di un dente, l’osso alveolare subisce una notevole alterazione volumetrica. Le ragioni alla base di questo processo sono ancora in parte sconosciute, ma l’assenza di funzione, il ridotto apporto sanguigno, infiammazione localizzata e trauma giocano un ruolo importante dal momento che il rimodellamento osseo è un processo complesso che implica fattori fisiologici, strutturali e funzionali.
Sappiamo che il processo di guarigione dell’osso aleveolare dopo un’estrazione si divide in due fasi: nella prima il bundle bone è rapidamente riassorbito e sostituito da woven bone con una conseguente riduzione volumetrica in senso verticale; nella seconda fase la superficie esterna dell’osso alveolare si riassorbe causando una contrazione orizzontale. La socket preservation si pone come fine proprio quello di limitare il più possibile questa contrazione, in funzione di una riabilitazione implanto-protesica che altrimenti risulterebbe difficile o meno efficace (Darby et al. 2009; Barone et al. 2011).
Ma se tutte le avulsioni dentarie sono seguite da una riduzione volumetrica della cresta ossea, la socket è sempre necessaria? Essa in realtà dovrebbe essere limitata a precise condizioni cliniche, ovvero ai casi in cui l’inserimento implantare non possa essere effettuato nell’immediato post-estrattivo, quando il paziente non sia disponibile per un post-estrattivo, quando non possa essere ottenuta la stabilità primaria dell’impianto o nel trattamento di pazienti in età adolescenziale. (Hammerle e al 2012)
Negli anni sono state proposte numerose tecniche chirurgiche che possono avvalersi o meno di materiali da innesto, membrane, innesti connettivali, e differiscono per il tipo di lembo. Allora quale tecnica utilizzare? Ebbene, ad oggi non esiste ancora una tecnica che assicuri in maniera univoca il successo più delle altre (Vignoletti e al 2011). Quel che è certo, è che le diverse tecniche di socket preservation sono effettivamente in grado di limitare il riassorbimento orizzontale e verticale (Vittorini Orgeas e al 2013,).
Un dato che emerge dalla letteratura è che il trauma chirurgico prodotto durante l’intervento potrebbe essere un fattore in grado di influenzare l’efficacia del trattamento, tanto che in alcuni studi si è dimostrato fondamentale limitarlo il più possibile al fine di ottenere un buon risultato [S. Fickl et al 2008.]
Infatti, oltre alla fase estrattiva, che per questa ragione dovrebbe essere il più atraumatica possibile, è stato ipotizzato che anche il sollevamento di un lembo mucoperiosteo possa giocare un ruolo importante nella guarigione del sito post-estrattivo dal momento che l’interruzione dello strato di cellule osteogeniche nel periostio maturo potrebbe diminuirne la capacità rigenerativa.
Ciononostante, i risultati in merito sono contrastanti, tanto che alcuni autori riportano un’ effettiva riduzione del rimaneggiamento osseo a seguito di procedure flapless (Fickl e al 2008) mentre altri non riscontrano alcuna significativa differenza (Araujo e Lindhe 2009, Barone e al 2014)
LE TECNICHE CHIRURGICHE
Le procedure di ridge preservation, in realtà, sono molto varie. In genere prevedono l’utilizzo di biomateriali da inserire nell’alveolo post-estrattivo, associando l’innesto a membrane (di varia natura) o il solo utilizzo della membrana. Il concetto di socket preservation, infatti, è spesso assimilato a quello di GBR, per il vantaggio che una barriera fornirebbe consentendo una ripopolazione cellulare selettiva. Questa procedura viene altresì utilizzata negli alveoli con difetti ossei che necessitano di bone augmentation ed è stata proposta per un’ipercorrezione del piatto vestibolare, allo scopo di compensare la fisiologica contrazione della cresta con risultati contrastanti (Fickl e al 2009).
Le tecniche di preservazione crestale possono essere effettuate con o senza sollevamento di un lembo mucoperiosteo. Ciò che accomuna tutte le tecniche è la necessità di effettuare l’estrazione in maniera meno traumatica possibile, in modo da preservare l’alveolo postestrattivo e di garantire la stabilità del coagulo.
In una revisione sistematica del 2009 di Darby e al, sono stati valutati 9 diversi metodi di ridge preservation. Tra questi, il più comune era l’innesto di biomateriale con membrana e lembo d’avanzamento a ricoprire parzialmente o totalmente l’alveolo. Il secondo prevedeva il solo innesto di biomateriale. Il terzo, membrana con chiusura per prima intenzione con lembo. Gli altri metodi comprendono diverse combinazioni di materiali da innesto. In questo studio tutte le tecniche analizzate che si avvalevano di membrane, prevedevano il sollevamento di un lembo. Dalla comparazione di queste tecniche, e dal confronto con la guarigione normale nei gruppi-controllo emergeva con una forte evidenza, che la ridge preservation limitava in maniera significativa la riduzione in altezza e in spessore della cresta ossea. Emergeva anche che la chiusura per prima intenzione non era necessaria al successo della tecnica, dato che i risultati tra i diversi metodi erano sovrapponibili (in contrasto con studio di Vignoletti del 2012).
Questi risultati sono confermati anche da recente studio su animale di Jung, che analizzando 4 diverse tecniche di preservazione di cresta con sollevamento di un lembo, ha osservato come esse, pur rivelandosi tutte efficaci, non mostrano differenze in termini di riassorbimento osseo, per quanto gli stessi studiosi ammettano che la causa potrebbe essere individuata nel trauma chirurgico a carico del periostio, che nelle tecniche di bone augmentation potrebbe averne limitato gli effetti.
Proprio partendo dall’idea che il minor traumatismo possibile a carico dei tessuti ne avrebbe ulteriormente limitato il riassorbimento, Tarnow ha ideato una tecnica di ridge preservation nota come “ice cream cone technique”, letteralmente “tecnica del cono gelato”. Essa si avvale di una membrana riassorbibile in collagene ripiegata a formare un cono e inserita nell’alveolo post-estrattivo, in cui viene successivamente posto un innesto di FDBA. Tale tecnica analizzata in un recente studio d lui condotto nel 2014 porterebbe ad un riassorbimento medio a sei mesi di 1,32mm a fronte dei 4mm osservati da Van der Weijden et al.
Tra gli studi a favore della preservazione di cresta senza lembi (Fickl e al 2008), anche Barone et al. nel 2014 avevano mostrato come la procedura flapless, confrontata ad una tecnica con sollevamento di un lembo a tutto spessore, portasse ad una riduzione del riassorbimento osseo soprattutto in senso orizzontale.
Al contrario, Vignoletti e al. nel 2011 mettendo a confronto diverse tecniche chirurgiche avevano riscontrato risultati migliori in termini di riassorbimento orizzontale nei casi in cui era stato scolpito un lembo mucoperiosteo. Secondo gli autori ai fini del successo delle tecniche con lembo potrebbe aver giocato un ruolo la chiusura per prima intenzione, che abbiamo invece visto non essere ritenuto un fattore importante in studi precedenti (Darby e al 2009). Altri studi ancora non riscontrano alcuna differenza (Araujo e Lindhe 2009).
Sebbene l’evidente eterogeneità di risultati, tutti hanno in comune una preservazione solo parziale della cresta ossea. Pertanto nel tempo sono stati sviluppati dei materiali da innesto allo scopo di implementare la risposta biologica dei tessuti. Nonostante essi differiscano per origine e caratteristiche, tutti devono rispettare determinate proprietà. Nello specifico il materiale da innesto ideale dovrebbe essere osteoinduttivo, osteoconduttivo, biocompatibile, sterile e biomeccanicamente stabile, ovvero dovrebbe avere la capacità di mantenere lo spazio il più a lungo possibile (Scarano et al. 2010; Brugnami et al. 1999).
INNESTI
I biomateriali possono essere classificati in base al tempo di riassorbimento in riassorbibili, non riassorbibili e parzialmente riassorbibili, oppure in base all’origine, possono essere suddivisi in biologici e sintetici. In questo articolo andremo ad esaminare quelli biologici.
INNESTO AUTOLOGO
Quel che più si avvicina al materiale d’innesto ideale, attualmente, è l’osso autologo, ad oggi considerato il gold standard per la rigenerazione di difetti ossei per le sue capacità osteoinduttive e osteogeniche, oltre che per la totale osteocompatibilità. Nell’innesto sono presenti cellule (pre-osteoblasti e pre-osteoclasti) e proteine in grado di indurre il differenziamento dei preosteoblasti. Le sue caratteristiche variano in base alla sede del prelievo e al tipo d’osso utilizzato. Per quanto concerne il tipo d’osso, è noto come quello corticale, essendo osso compatto, sia caratterizzato da periodi di rivascolarizzazione e di successivo riassorbimento più lunghi. Quello midollare, per sua natura poroso, viene rivascolarizzato in poche settimane e riassorbito in tempi più brevi. Per quanto riguarda la sede di prelievo è dimostrato che l’osso della cresta iliaca e il midollo sono i più predicibili e quelli col maggior potenziale osteoinduttivo, mentre per quanto riguarda i prelievi dalle sedi intraorali sono da preferirsi le regioni più ricche di osso midollare, il quale ha un maggior potenziale osteogenico.
Il maggior limite dell’innesto autologo, che è anche la causa del suo scarso utilizzo, è la necessità di un ulteriore intervento chirurgico per il prelievo e quindi una maggiore morbilità post operatoria.
Gli altri tipi di innesti, prelevati da individui diversi dal ricevente, hanno il vantaggio di poter essere disponibili in maggiori quantità senza dover ricorrere ad un secondo intervento sul paziente, pur presentando l’inconveniente di avere minori o nulle capacità osteoinduttive, tempi maggiori di rivascolarizzazione e di poter trasmettere patogeni al ricevente. Essi vengono classificati in base alla sede d’origine in:
- allogenici (FDBA and DFDBA),
- xenogenici (bovino or suino),
- alloplastici (hydroxyapatite, tricalcium phosphate, bioactive glass).
INNESTI OMOLOGHI (allograft)
Per innesto omologo o allogenico s’intende un tessuto innestato su un organismo della stessa specie di quello d’origine, ma geneticamente dissimile. Questo tipo di materiale da innesto viene distinto in DFDBA (demineralized freeze-dried bone allograft) e FDBA (mineralized freeze-dried bone allograft).
Per quanto riguarda l’FDBA, esso è biocompatibile e ha proprietà osteoconduttive ed è caratterizzato da un lungo tempo di riassorbimento.
Il DFDBA è ottenuto a seguito della demineralizzazione del tessuto osseo, con cui si otterrebbe il rilascio di BMP, il fattore responsabile della differenziazione delle cellule mesenchimali indifferenziate in osteoblasti. Su questo aspetto la letteratura si divide tra chi sostiene che in realtà non vi sia differenza tra i due tipi d’innesto e che anzi, l’FDBA abbia maggiori capacità osteoconduttive (Piattelli A e al.1996 ; Yukna RA e al 2005) e chi sostiene che il DFDBA abbia capacità osteoinduttive e sia quindi migliore del FDBA.
Healey e Wood nel 2012, ad esempio, hanno condotto uno studio istologico in cui pur non riscontrando differenze significative in termini di ridge preservation, hanno rilevato negli interventi con DFDBA una maggiore percentuale di osso vitale e una minore percentuale di particelle d’innesto residue.
Per quanto concerne i tempi di riassorbimento, anche l’osso demineralizzato viene riassorbito molto lentamente, anche se in tempi più brevi del FDBA.
In ogni caso entrambi i materiali si sono dimostrati efficaci nel mantenimento della cresta ossea post-estrattiva, come dimostrato anche da Ogihara S e Tarnow DP in uno studio longitudinale del 2014 in cui si confrontava l’efficacia di EMD solo e in associazione con FDBA e DFDBA.
A fronte dell’indubbia efficacia di questi materiali occorre però valutare la presenza di svantaggi importanti quali la possibilità di trasmettere infezioni al paziente ricevente, e soprattutto la mancanza d’istocompatibilità. Per questi motivi i materiali allogenici sono stati lentamente abbandonati, a favore dei materiali d’innesto xenogenici e alloplastici.
INNESTI ETEROLOGHI (o xenogenici)
Per xenogenico s’intende un materiale innestato da specie differente da quella umana. Di conseguenza, al fine di evitare una GVHD essi vengono deproteinizzati e di conseguenza privati di capacità osteoinduttiva. Tuttavia questi biomateriali mostrano una guarigione tissutale simile a quella degli innesti omologhi e un’elevata osteoconduttività. I due tipi più usati sono l’osso di origine bovina e quello di origine suina. Posti a confronto, entrambi si sono rivelati efficaci nel limitare il riassorbimento verticale e orizzontale della cresta ossea (Cardaropoli 2012)
L’osso bovino deproteinizzato è probabilmente il più comunemente usato, e nel tempo si è dimostrato adeguato a raggiungimento del successo chirurgico nella socket, (Artzi et al. 2000; Scarano et al. 2010; Cardaropoli e al 2012), soprattutto per i più lunghi tempi di riassorbimento che garantiscono un maggiore mantenimento di spazio. In uno studio di Araujo e Lindhe del 2009 emerge come esso abbia una funzione osteoconduttiva, ma non osteoinduttiva, e sia in grado di limitare il riassorbimento crestale fungendo da scaffold per la formazione di nuovo osso. Alcuni studi indicano un incompleto riassorbimento e proliferazione di epitelio connettivale nelle zone di innesto del materiale (Becker et al. 1998; Carmagnola et al. 2000), mentre altri mostrano le particelle in diretto contatto con l’osso (Artzi et al. 2000). Carmagnola in uno studio del 2003 ha riscontrato un contatto diretto con l’osso in solo il 40% delle particelle, le quali dopo 6 mesi dall’estrazione permanevano ancora nell’alveolo. Nonostante il lungo tempo di riassorbimento, Artzi in uno studio del 2001 mostra come dopo 9 mesi di permanenza dell’alveolo, non era stato rinvenuto tessuto connettivo in contatto coi granuli, ciò dimostrava come il DBBM fosse un materiale biocompatibile adeguato alle procedure di socket preservation in cui si preferiscano tempi di riassorbimento più lunghi. Infatti il lento tasso di riassorbimento di alcuni biomateriali rappresenta clinicamente un vantaggio importante dal momento che questi ultimi concorrono a stabilizzare il sito, contrariamente all’osso autologo, con cui viene riscontrato un elevato tasso di riassorbimento rispetto al volume originario (Sbordone e al 2011). Per contro, Carmagnola e al nel 2003 in uno studio molto simile in cui era stato adoperato il DBBM come materiale da innesto, avevano osservato che le particelle di biomateriale persistevano oltre 6 mesi dall’estrazione e che solo il 40% era in diretto contatto con l’osso.
Dalla letteratura emerge come non esistano risultati univoci riguardo il comportamento dei biomateriali, sui quali sono stati ottenuti spesso risultati molto diversi. Inoltre un’ulteriore difficoltà è rappresentata dall’individuazione di dati in letteratura che siano effettivamente validi e non inficiati da bias, data la scarsa quantità di studi ben disegnati (Vignoletti 2011).
CASI CLINICI
A seguire, vengono mostrati una serie di casi di socket preservation eseguiti con tre differenti tecniche. Per tutte le tecniche è importante che l’estrazione sia quanto più atraumatica possibile. Bisogna evitare di fare leva sull’osso alveolare. Per tale motivo nei casi in cui dobbiamo rimuovere un apice, possiamo avvalerci di strumenti appositi che ci permettano di estrarre la radice senza ledere le strutture circostanti. Esiste anche la possibilità di utilizzare i files endodontici per aiutarci in queste estrazioni.

Bio-Oss® collagen + mucograft
Il Bio-Oss Collagen. Consiste in un sostituto osseo eteronomo costituito per il 90% di particelle di osso bovino deproteinizzato e per il 10% di collagene suino con la funzione di rendere più facilmente manipolabile il materiale. Alcuni studi (Orsini G e al 2005; Jung RE e al 2013) ne hanno dimostrato le proprietà osteoconduttive e una buona integrazione nel neo-osso. Il materiale inoltre in virtù del suo lento riassorbimento è in grado di fornire un volume stabile nel tempo (Araujo MG e al 2010; Mordenfeld A e al 2012).
La Mucograft. Si tratta di una matrice in collagene 3D ideata come altre alternativa al prelievo di tessuto connettivo, composta da uno strato compatto esterno e da uno strato spugnoso interno che fornisce stabilità al coagulo consentendo la riparazione dei tessuti. Il tessuto autologo è infatti estremamente efficace ma prevede una procedura fastidiosa per il paziente, mentre, come dimostrato da alcuni studi, la mucograft riduce sensibilmente la morbilità postoperatoria (Sanz M e al 2009; Lorenzo R e al 2012) riducendo nel contempo la durata dell’intervento (Sanz M e al 2009; Cardaropoli D e al 2012). Tra i vantaggi apportati da questa matrice sembra esserci anche una riduzione dei tempi di guarigione rispetto al connettivo (Thoma D e al 2012), come dimostrato anche in uno studio di Mesceva e al del 2018 in cui valutando istologicamente il tessuto a sei mesi dall’intervento si apprezzava una differenza significativa tra i pazienti trattati con il free graft che presentavano un tessuto collagene ancora frammentato e tra i pazienti trattati con mucograft, i quali presentavano invece un tessuto maturo.
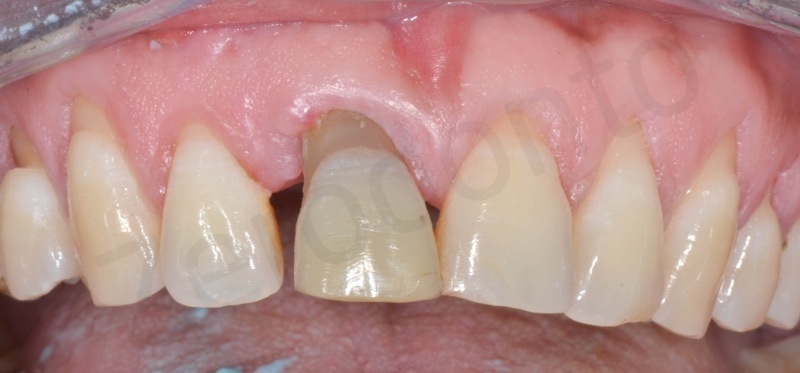
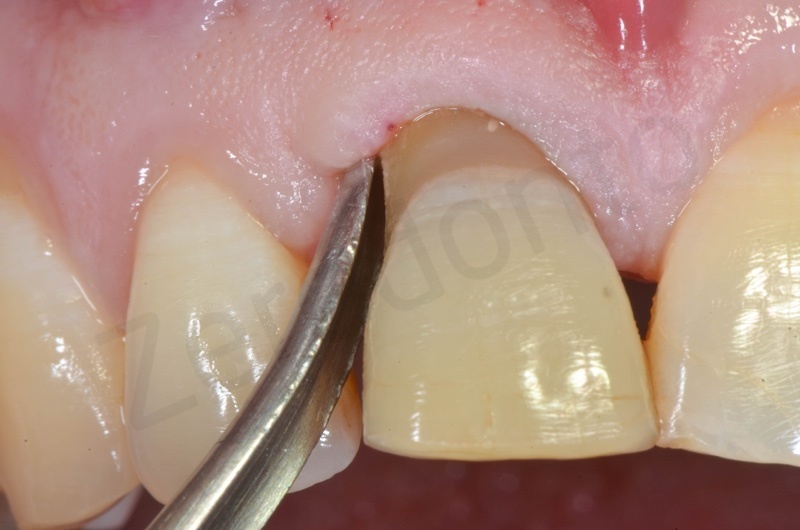
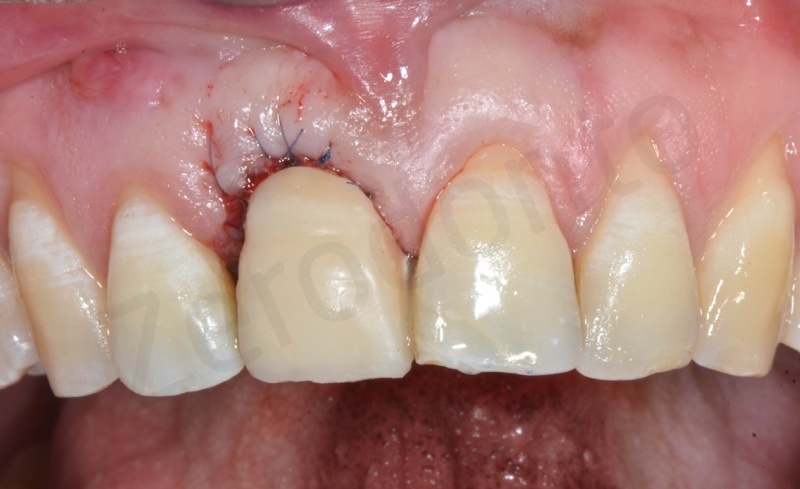
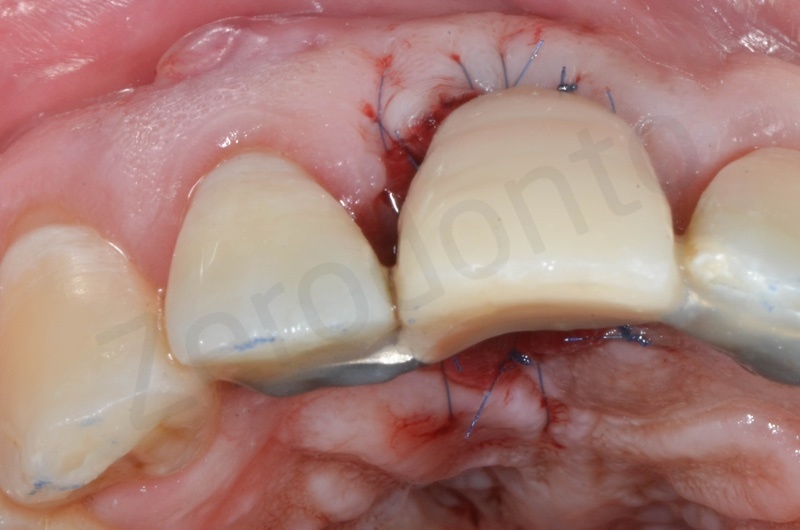
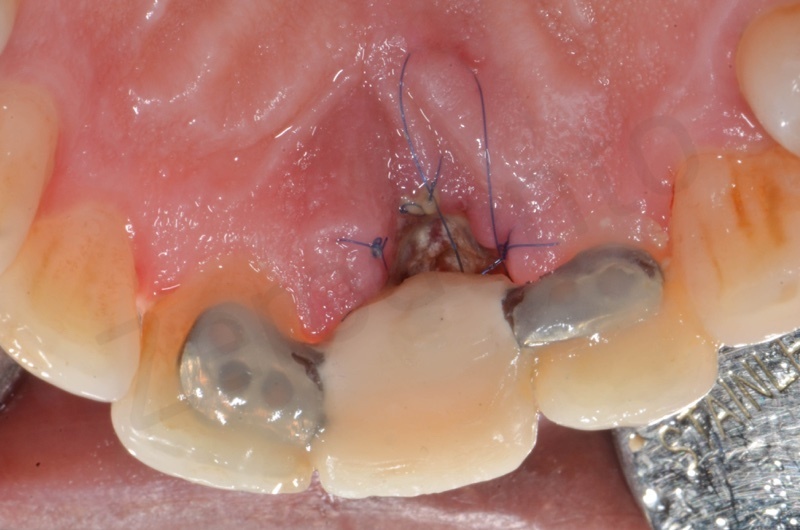
Caso clinico 1
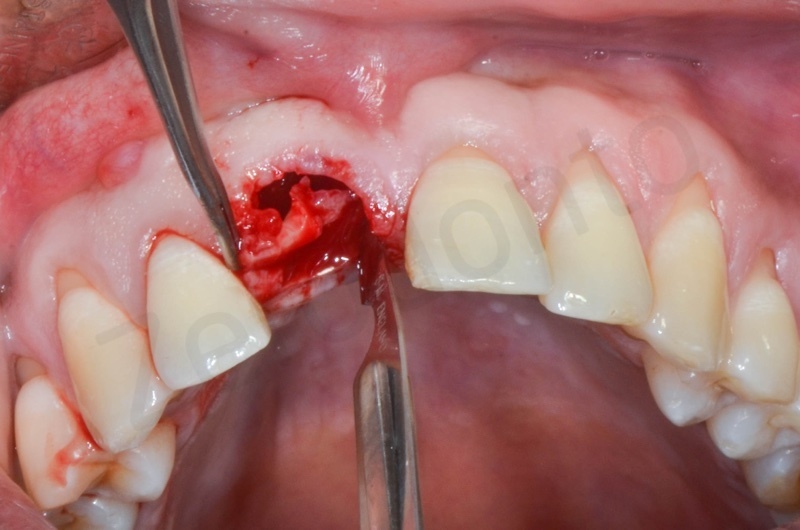
Viene effettuata l’estrazione atraumatica dell’1, con l’ausilio di una leva dritta e successivamente di una pinza.
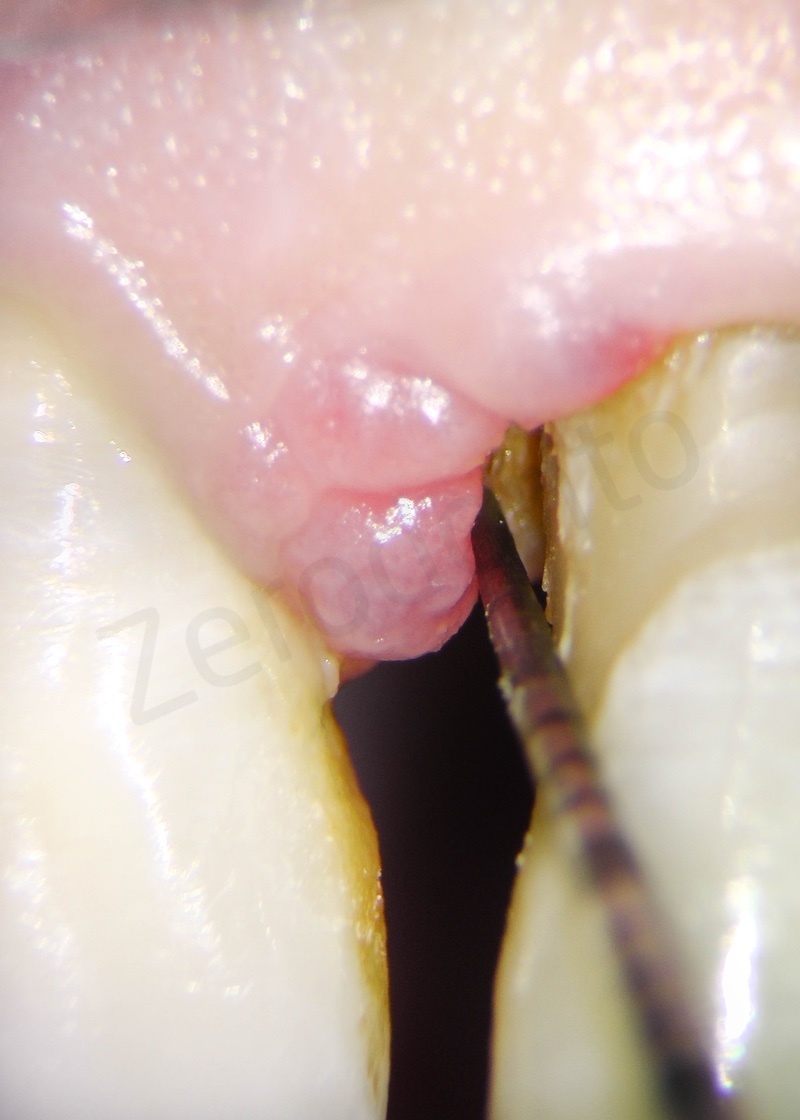
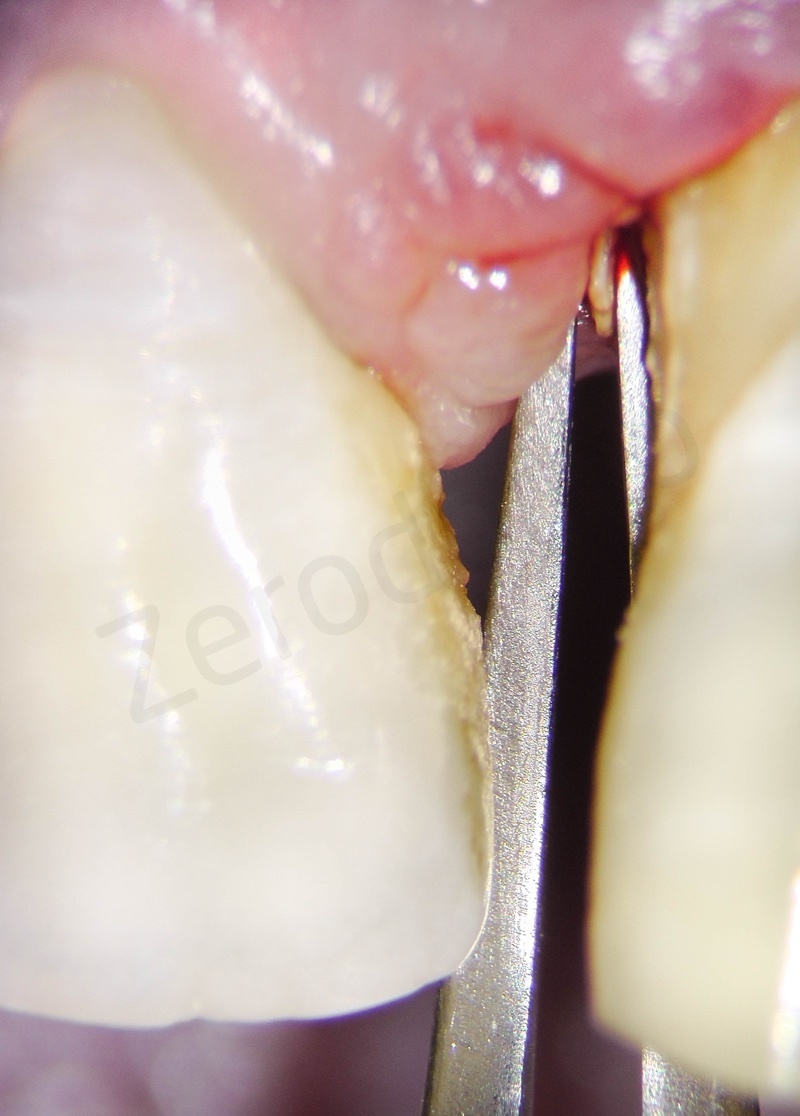
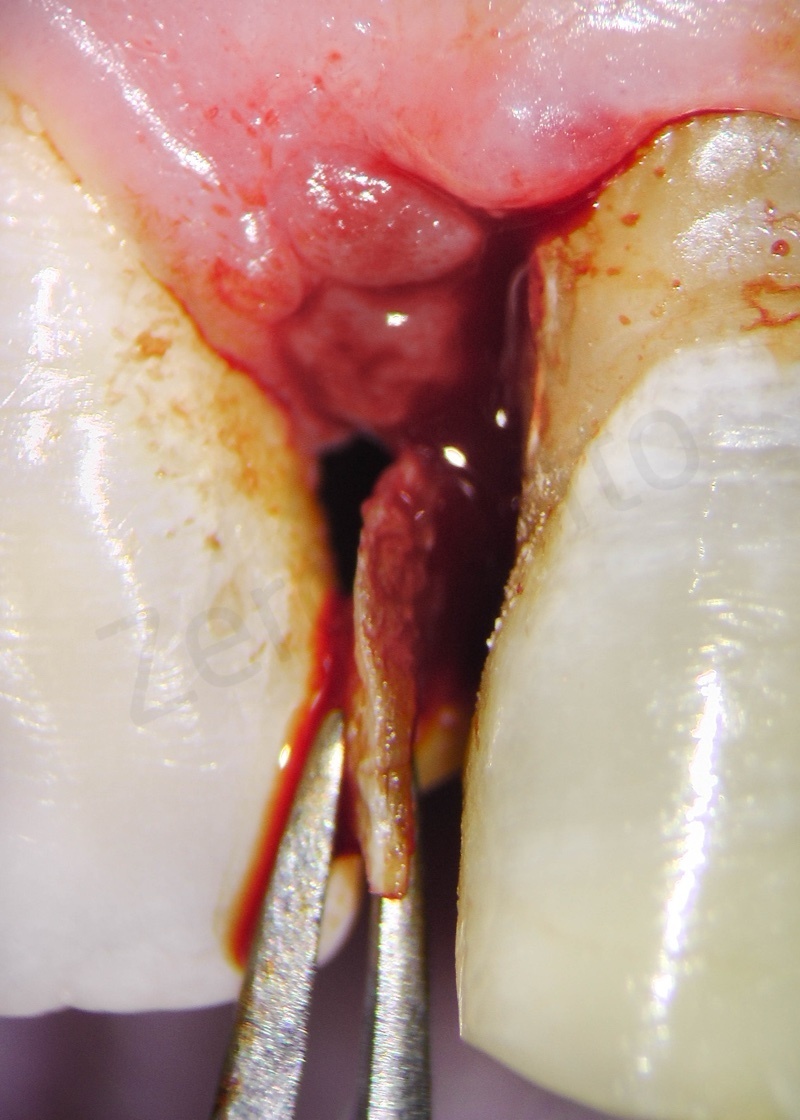
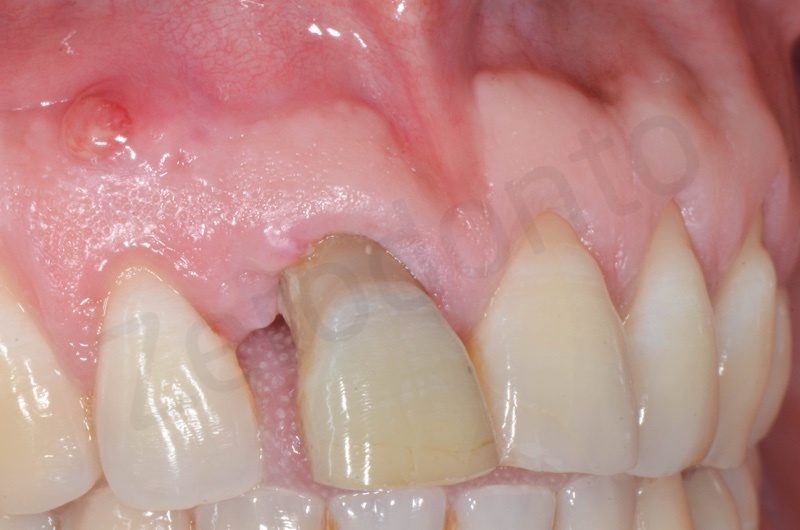
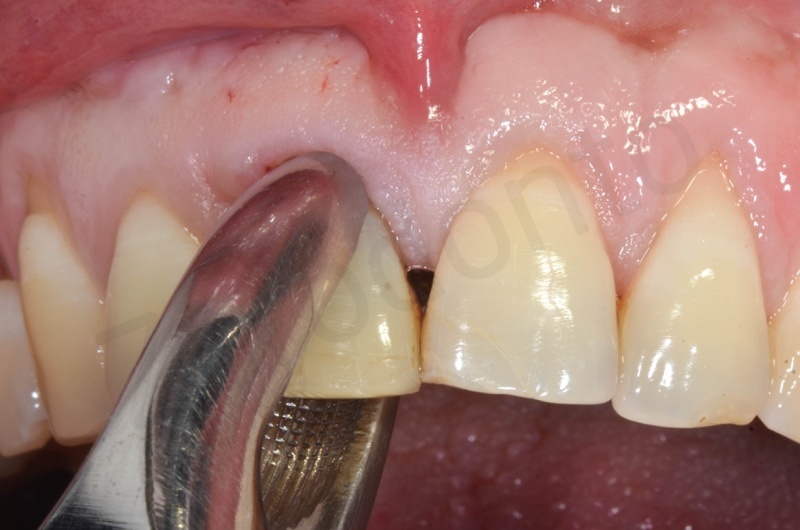
Rimozione dell’epitelio della tasca per mezzo di un bisturi 15c.
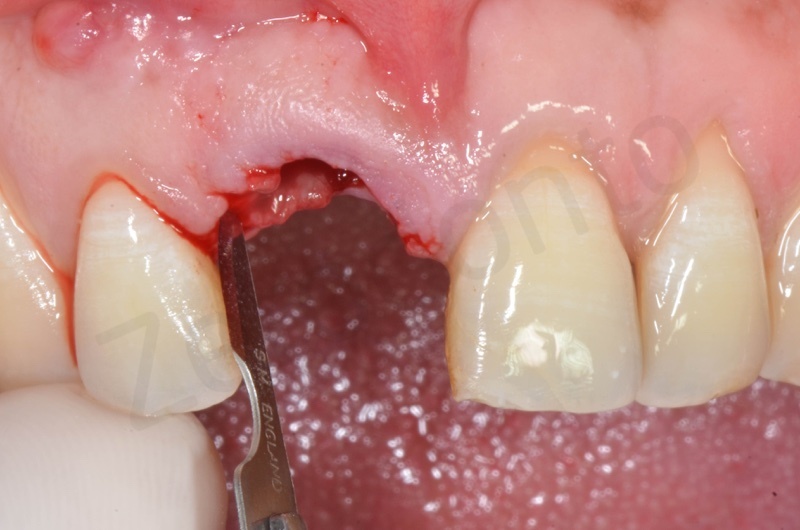
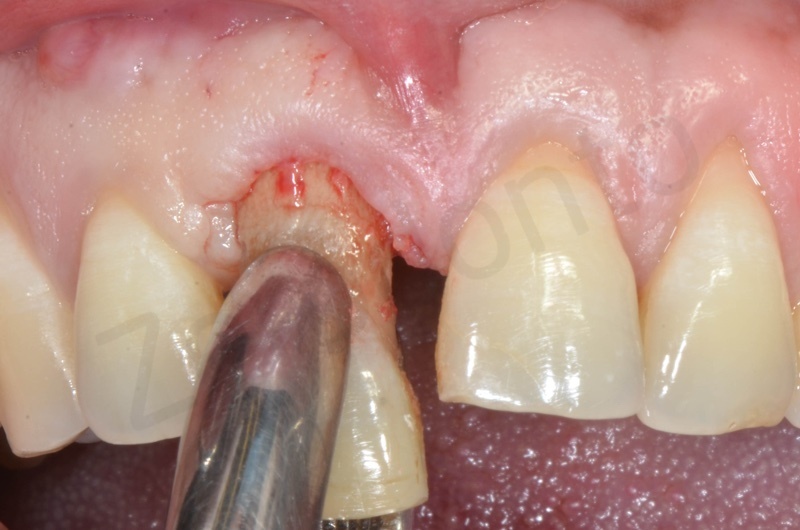
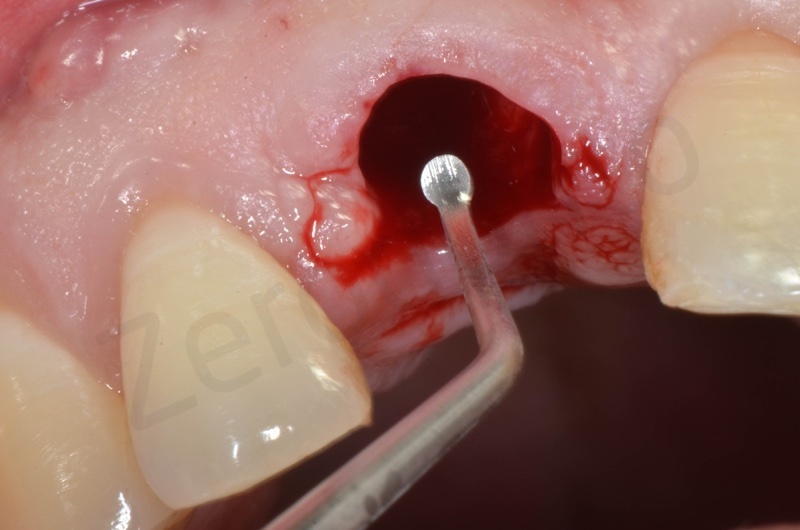
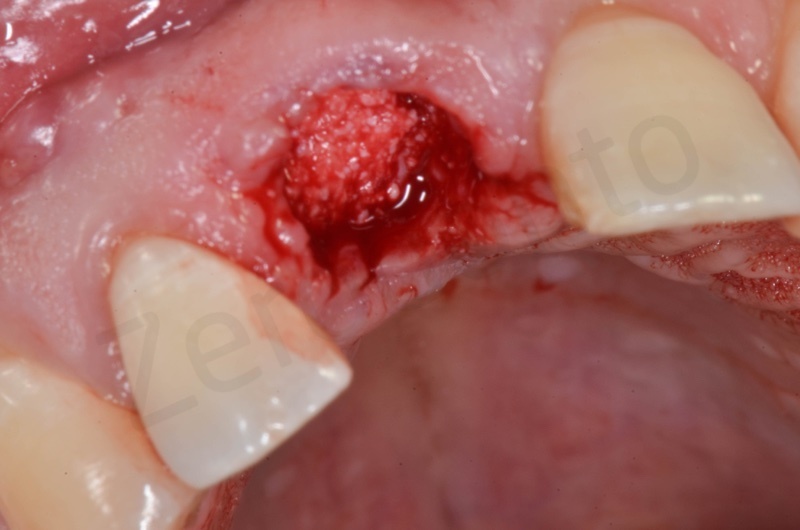
Curettage dell’alveolo post estrattivo al fine di rimuovere il tessuto di granulazione presente.
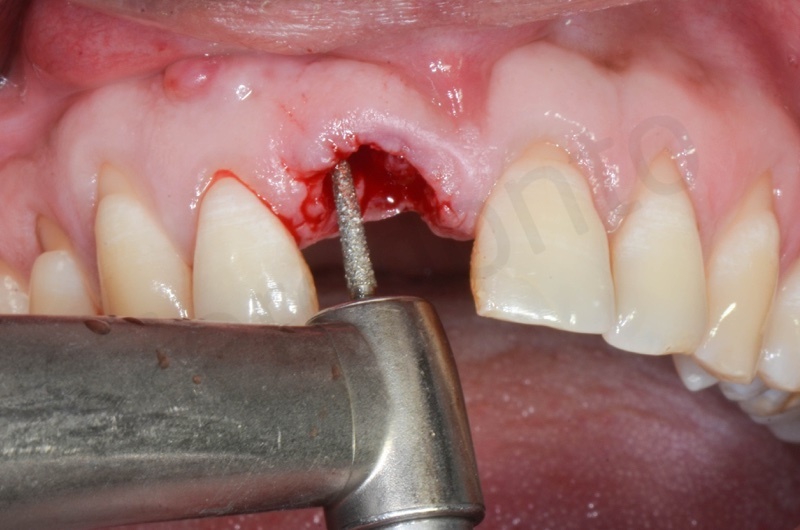
Disepitelizzazione dell’epitelio sulculare mediante una fresa diamantata a grana grossa, usata a basso numero di giri.
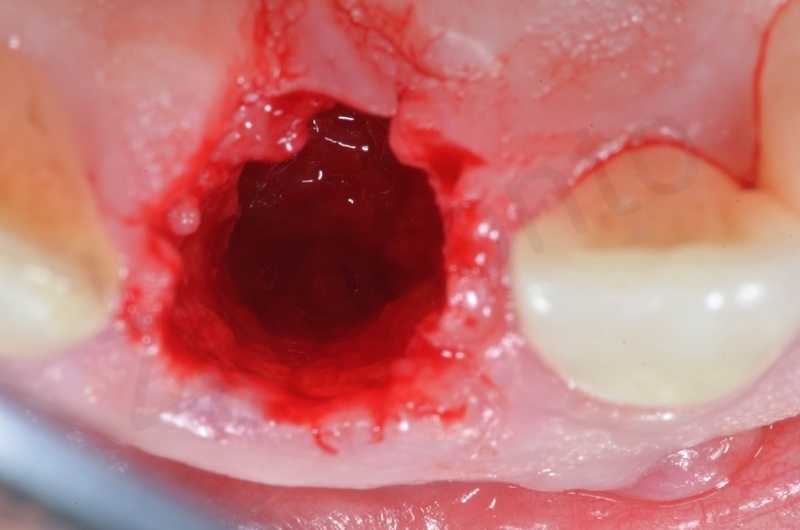
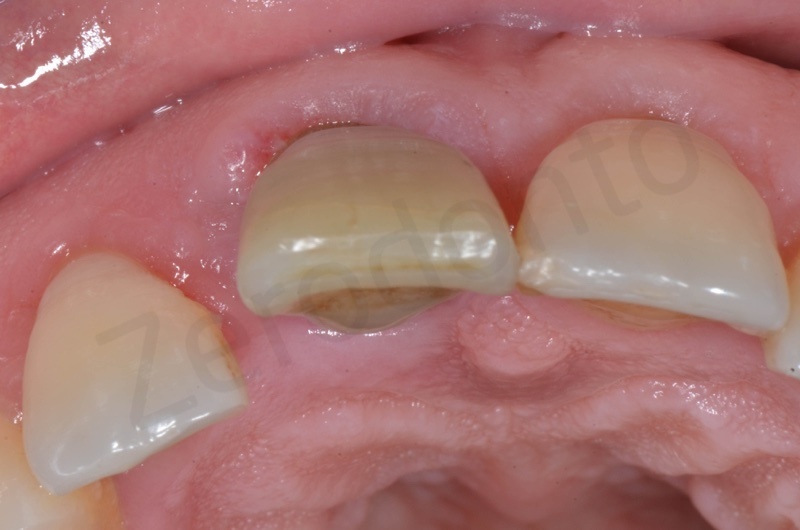
Inserimento del Bio-oss collagen.



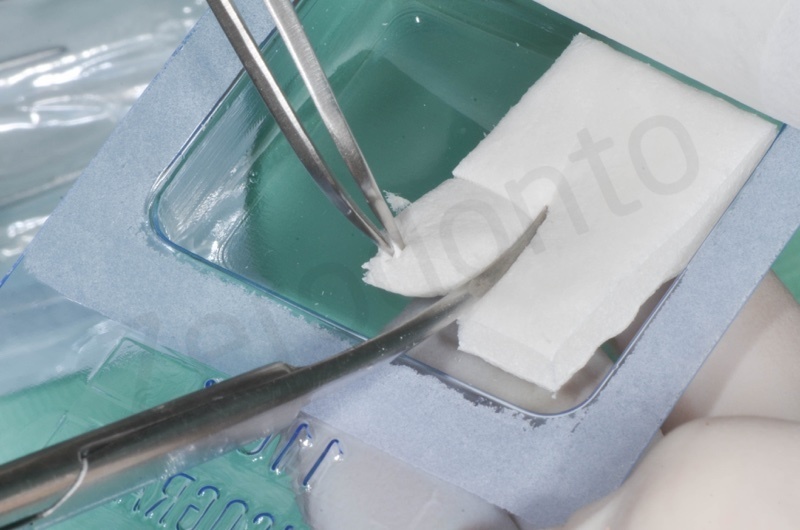

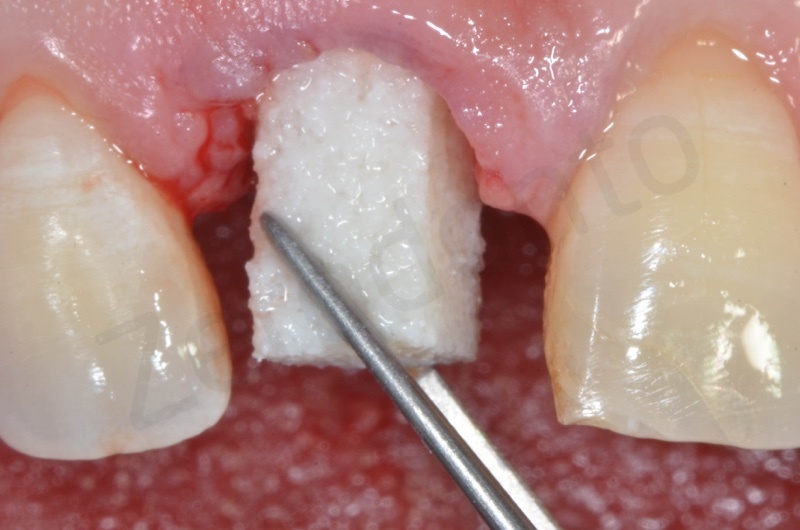
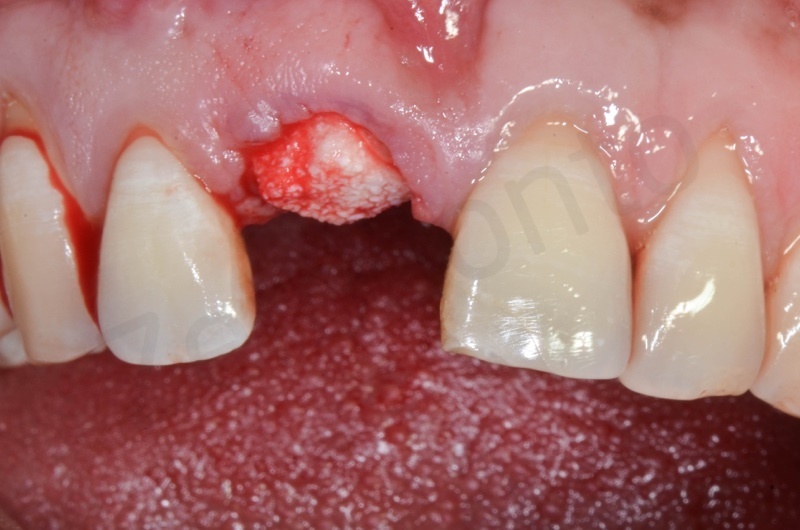
Applicazione della mucograft, con l’ausilio di punti di sutura.
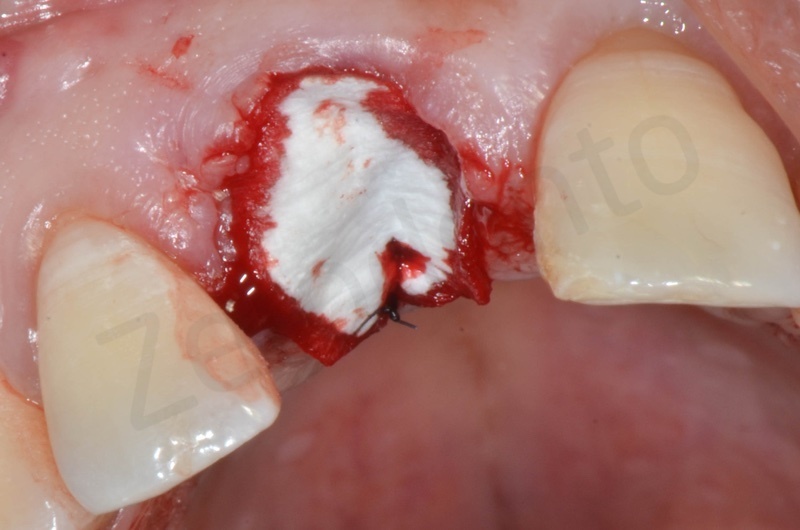
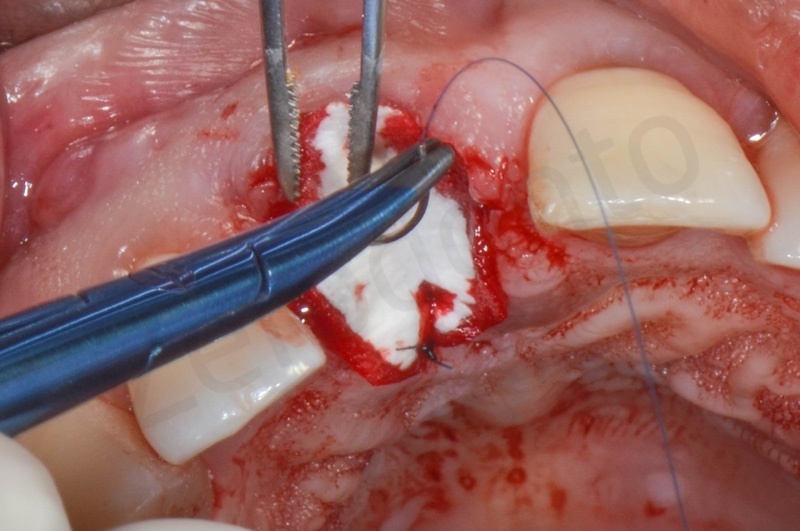
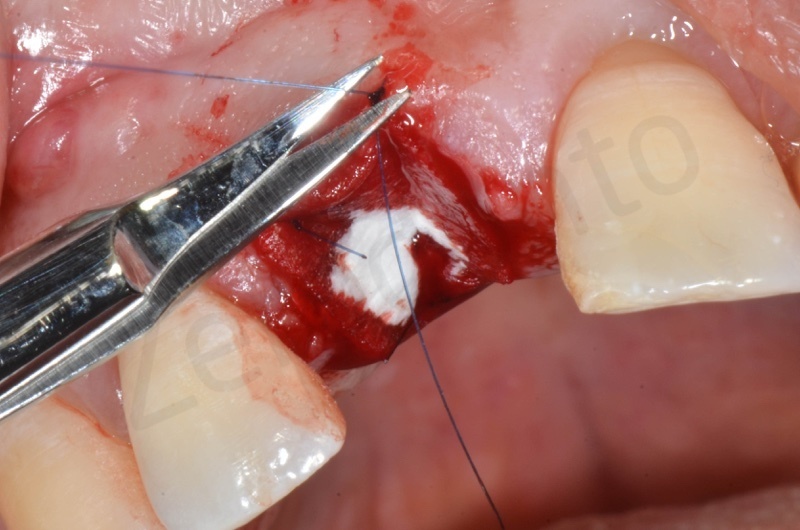
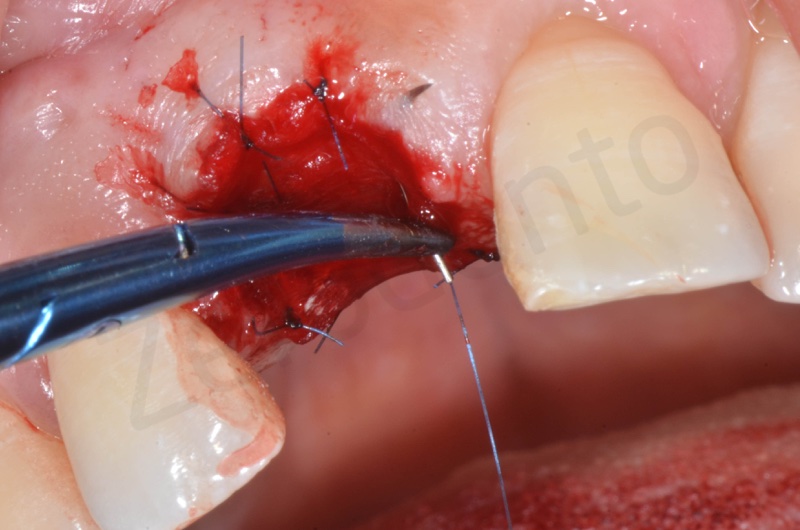
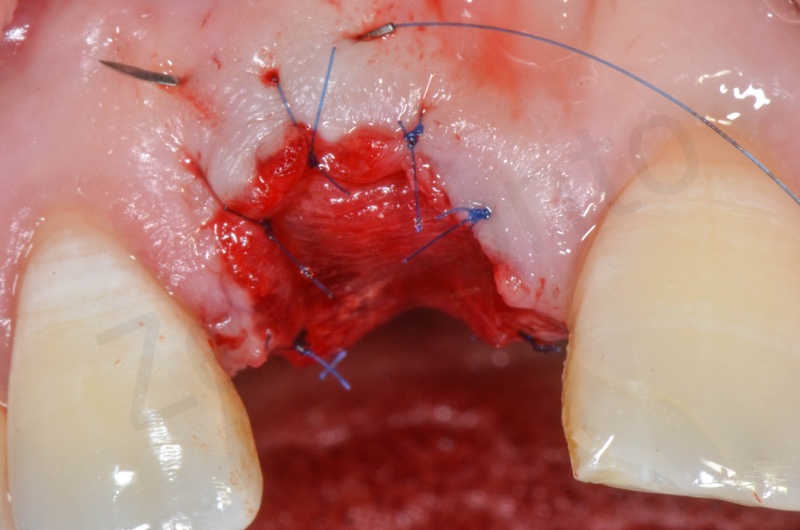
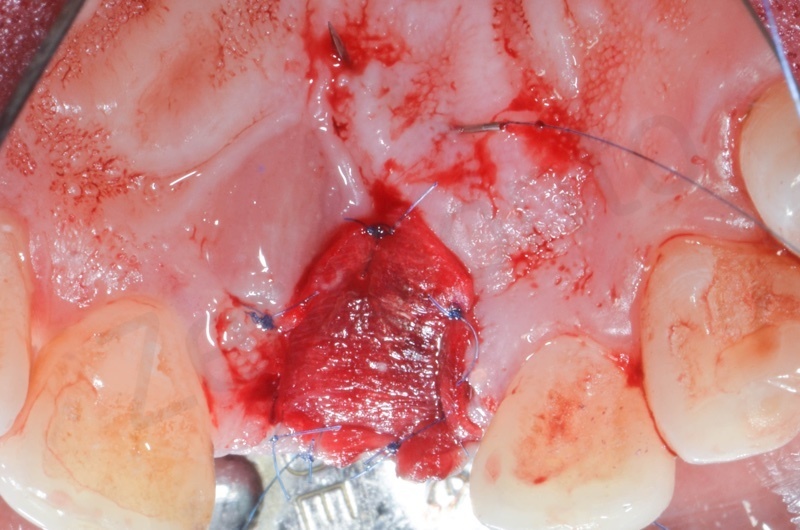
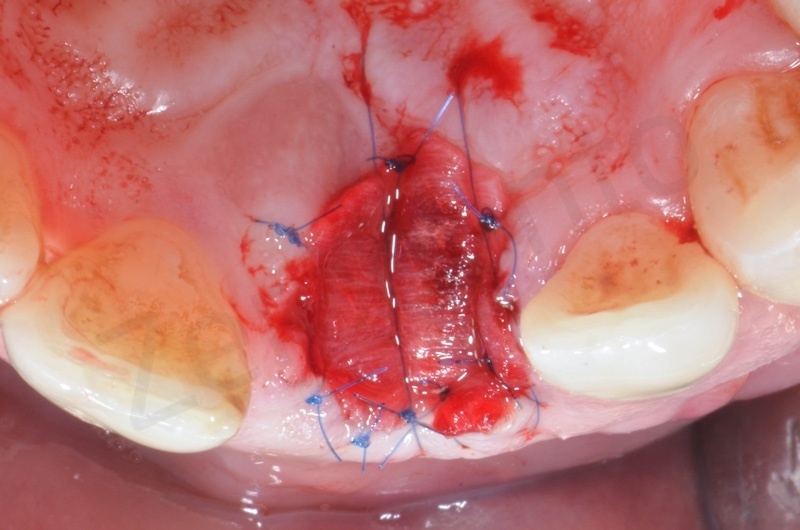
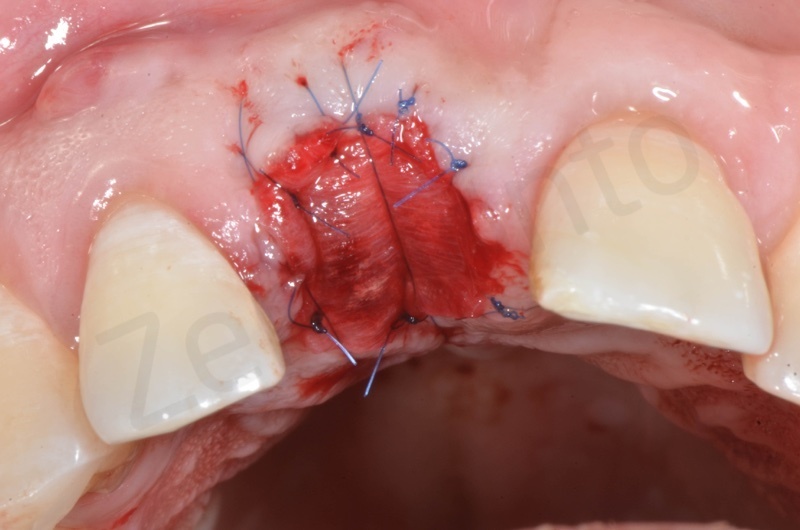
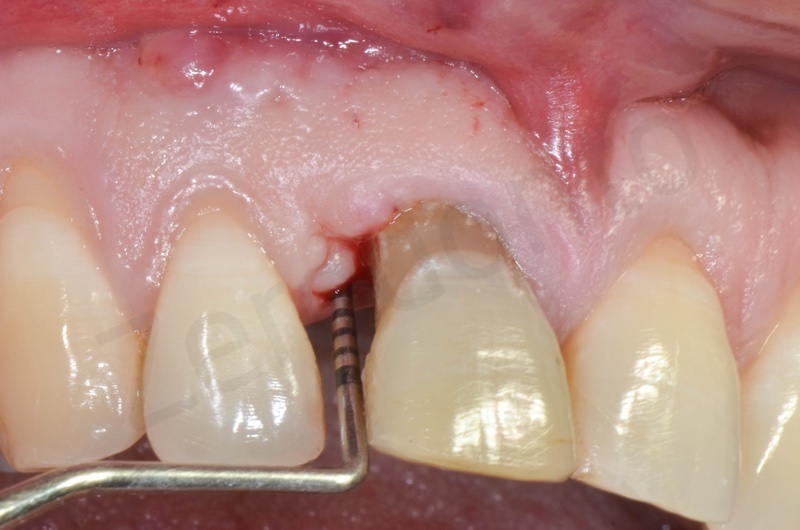
Applicazione di un maryland al fine di guidare la guarigione dei tessuti molli e di fornire una buona estetica post-chirurgia.
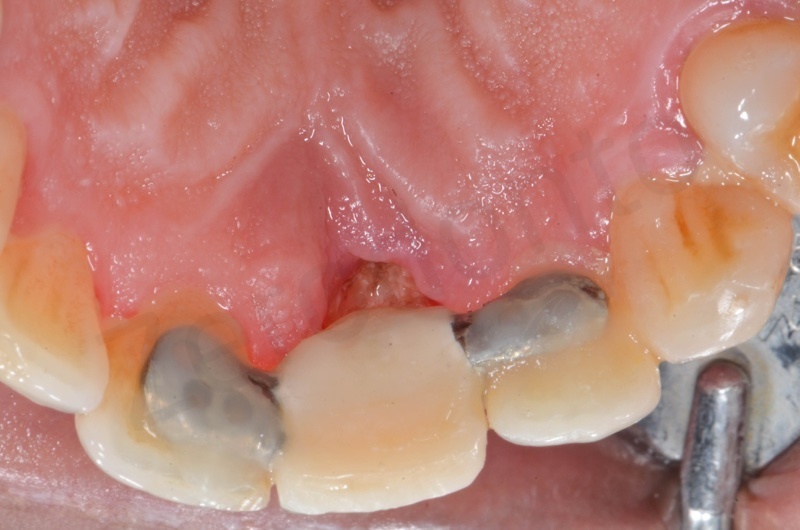
La guarigione ad una settimana.
Caso clinico 2
Paziente donna, 68 anni, non fumatrice
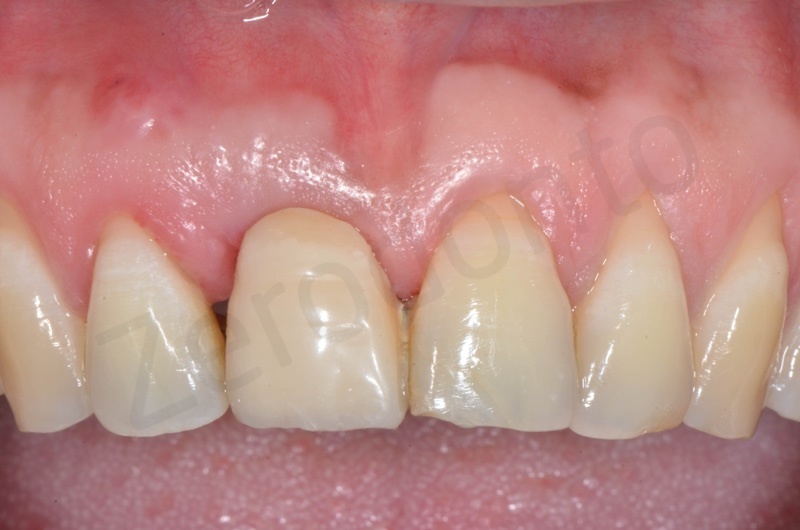
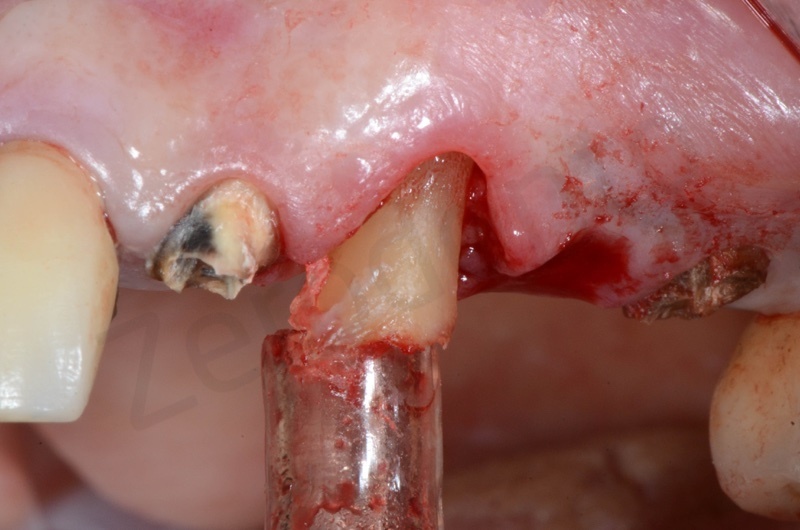
Presenza in arcata di radice di 22, 23, 25, dove 22 e 25 fungono da pilastri protesici di un ponte 22-25.
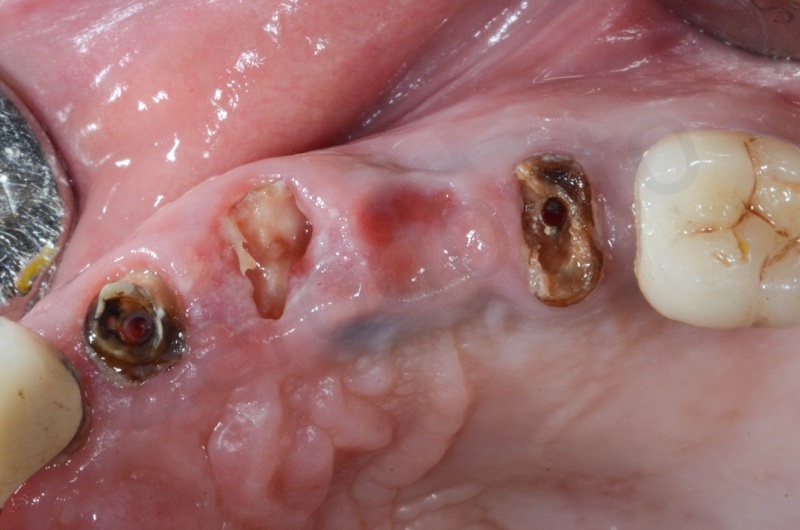
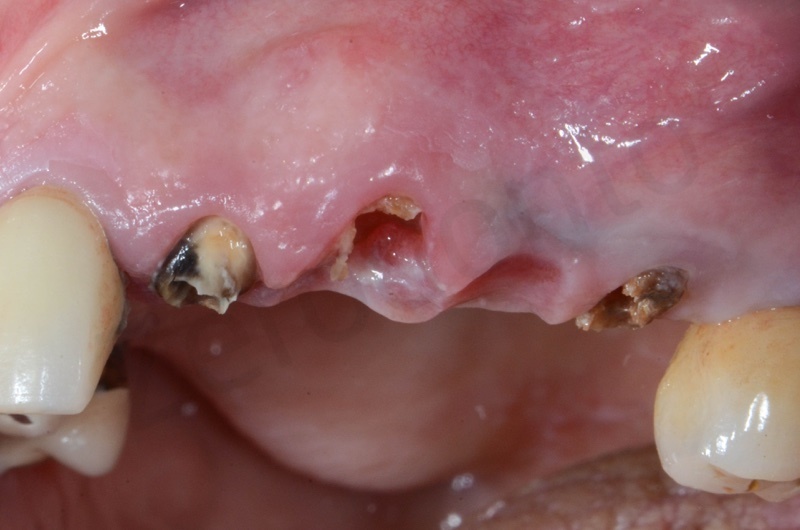
Si effettua l’estrazione della radice del 23, seguita dalla rimozione del tessuto di granulazione e dell’epitelio del solco. Il 22 e il 25 verranno estratti successivamente
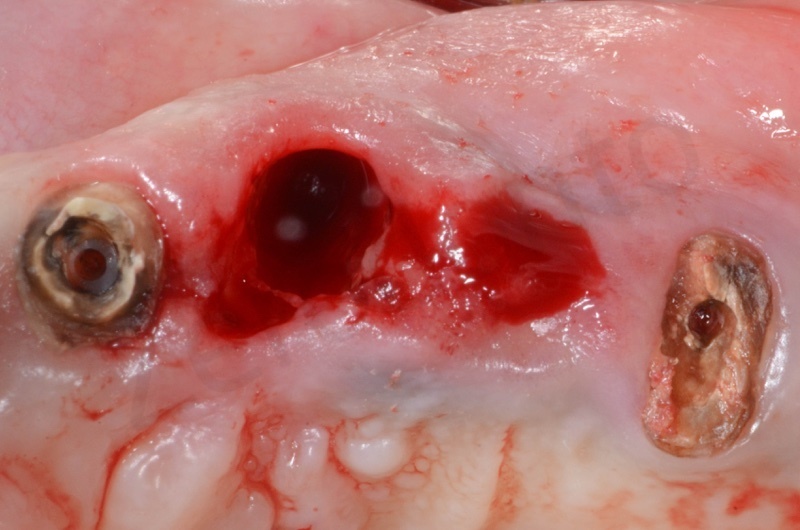
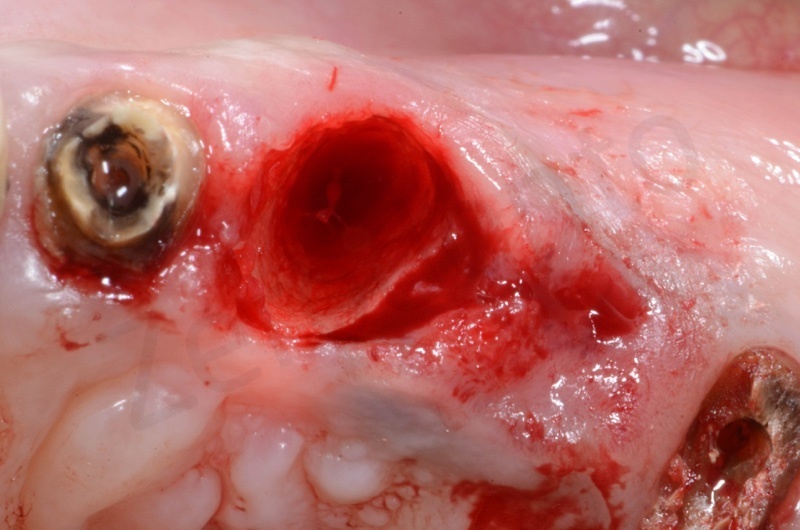
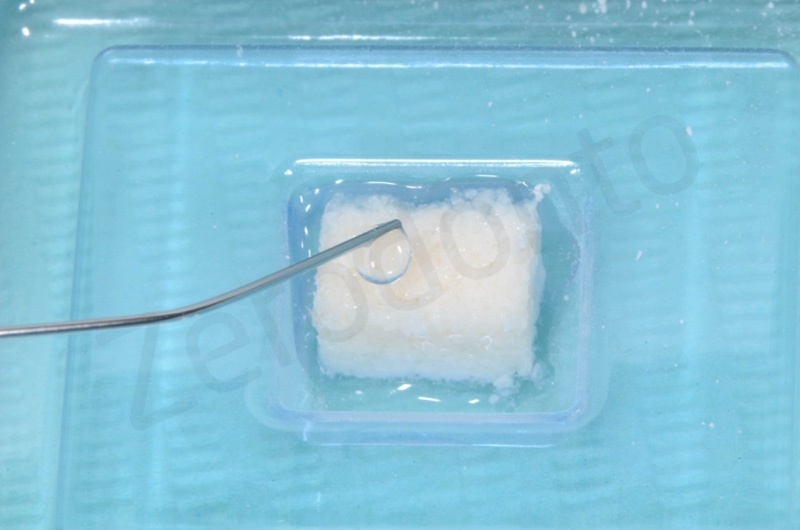
Il bioss collagen viene idratato con soluzione fisiologica
Bioss collagen una volta posizionato nell’alveolo
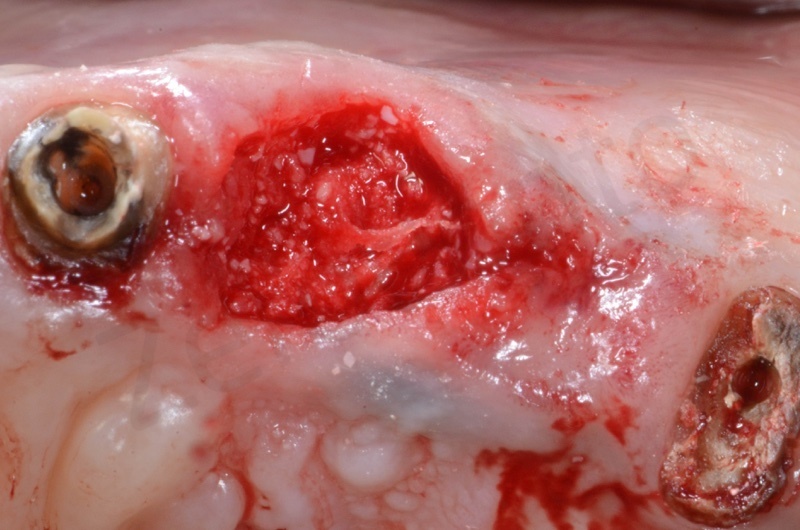
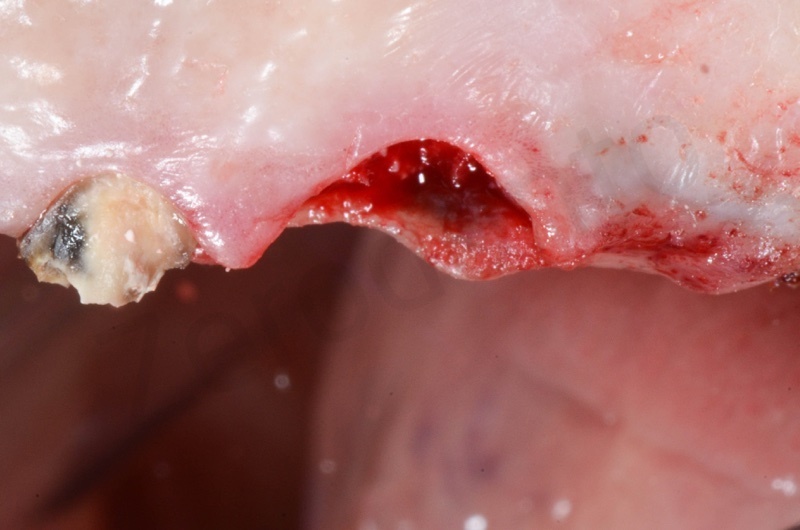
Si procede a misurare l’ampiezza dell’alveolo per determinare le dimensioni della mucograft
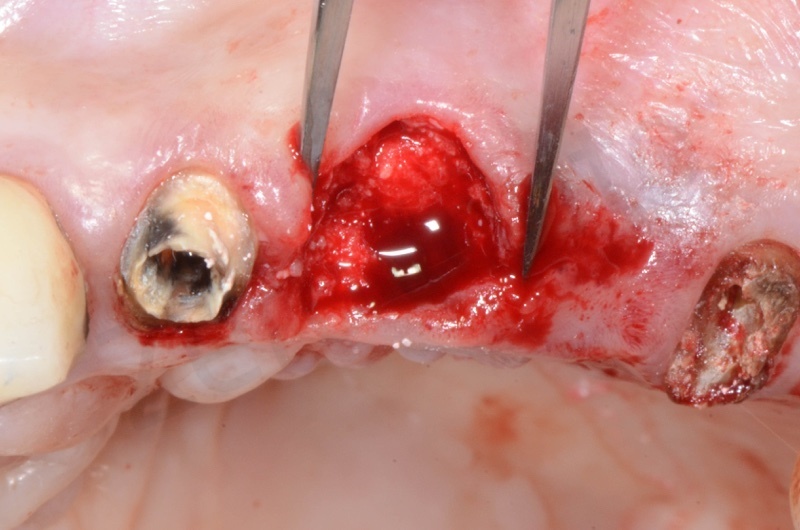

L’ampiezza riportata sul foglio di mucograft

Particolare al microscopio


La matrice viene posizionata e ancorata con suture
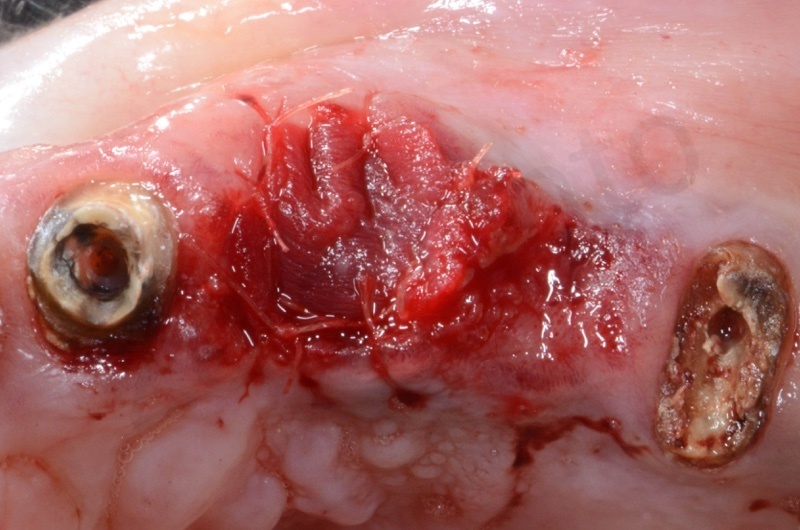
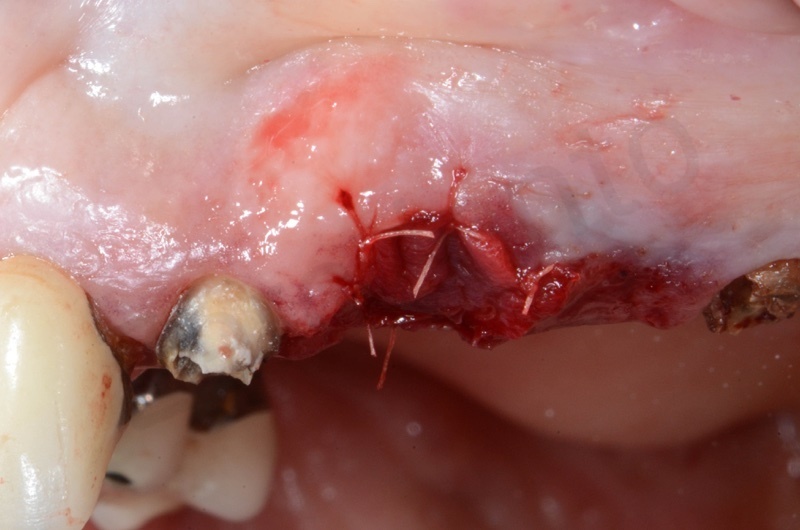
La guarigione ad una settimana
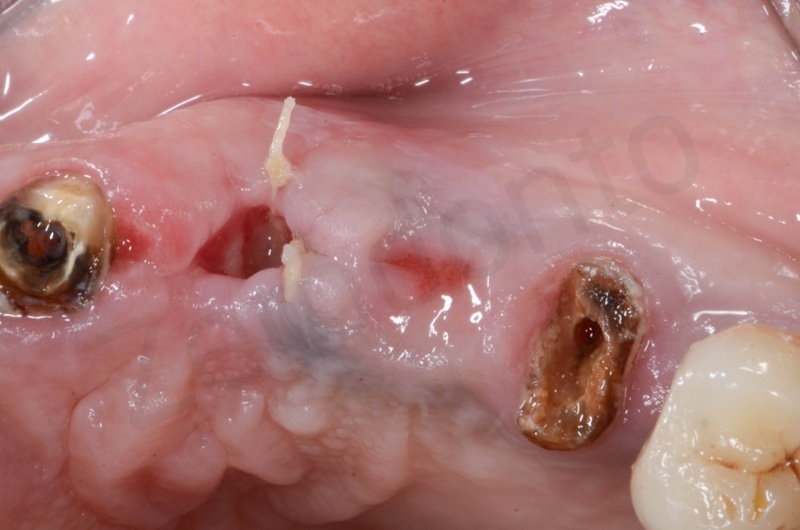
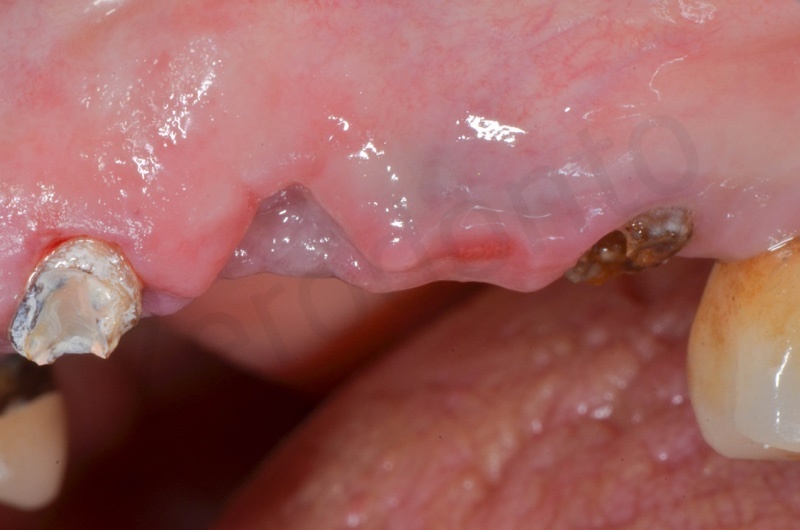
La guarigione dei tessuti ad un mese
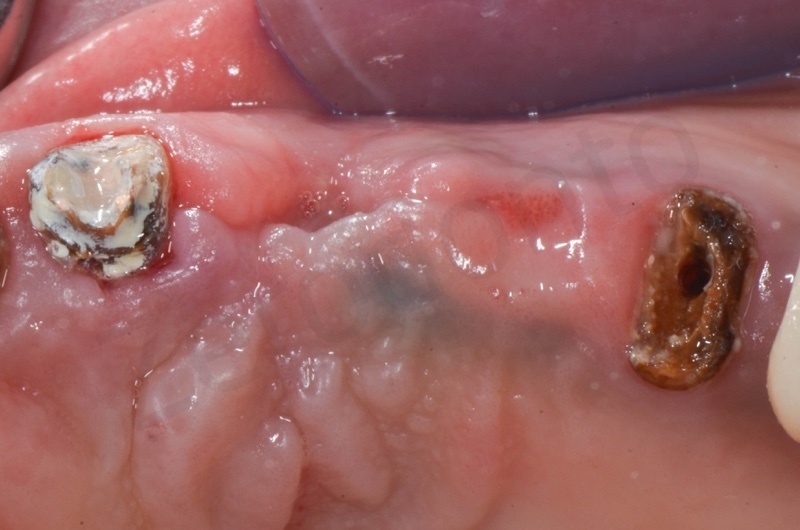
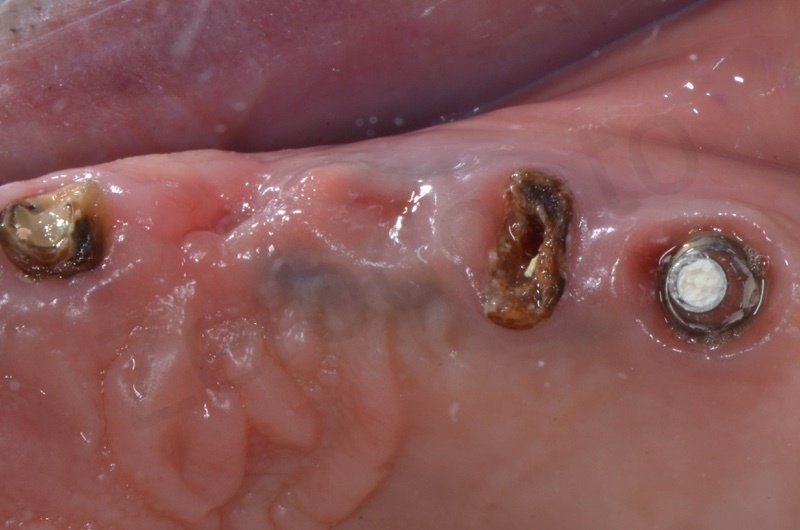
Guarigione dell’osso a tre mesi. Nel frattempo è stata rimossa anche la radice del 25 e posizionato un circolare su 4 impianti.
VIDEO: Caso Clinico 3 con Membragel e Mucograft
Bio-Oss® collagen + connettivo dal tuber
Paziente di 43 anni, donna. Parodontite aggressiva in stadio avanzato.
Inizio terapia parodontale non chirurgica con stabilizzazione parodontale e terapia ortodontica con retainer attivi.


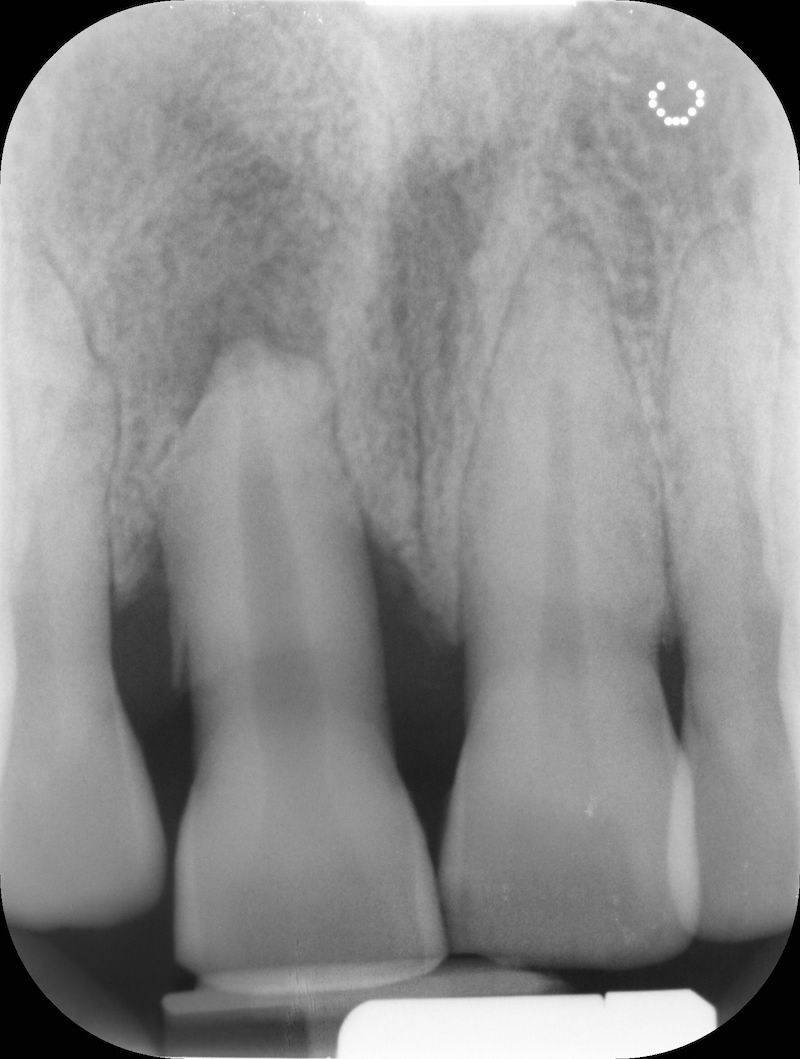
RX pre-op
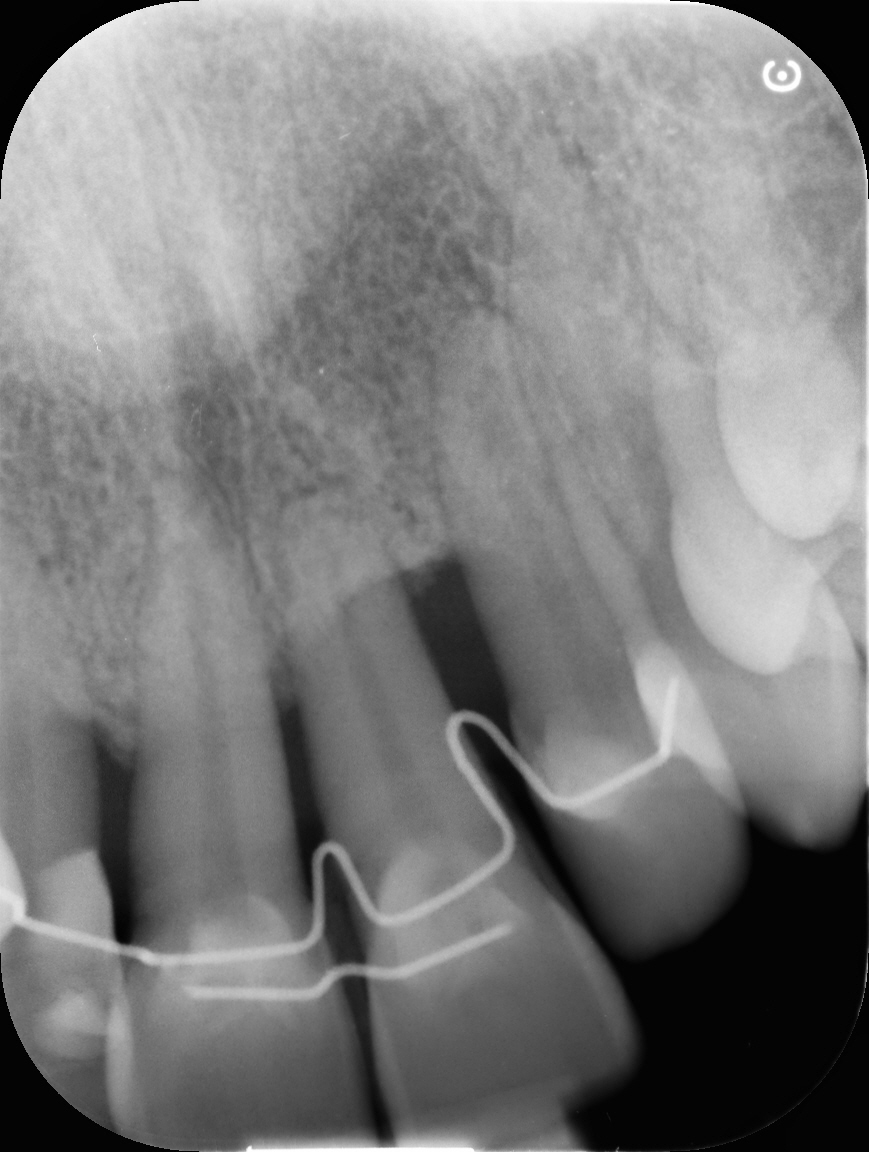
Estratto il dente, si procede alla rimozione dell’epitelio della tasca e del tessuto di granulazione




Il sito scelto per il prelievo di tessuto connettivale dal tuber

Il Bio-Oss® Collagen si presenta come un blocchetto rigido, prima dell’utilizzo viene idratato in soluzione fisiologica

Inserimento de Bio-Oss® Collagen nel sito post-estrattivo

Il materiale deve essere posizionato al livello del margine osseo.


Il connettivo prelevato dal tuber

L’innesto viene fissato al sito post-estrattivo mediante dei punti staccati in polipropilene 6-0




Successivamente viene posizionato un maryland

RX post-op
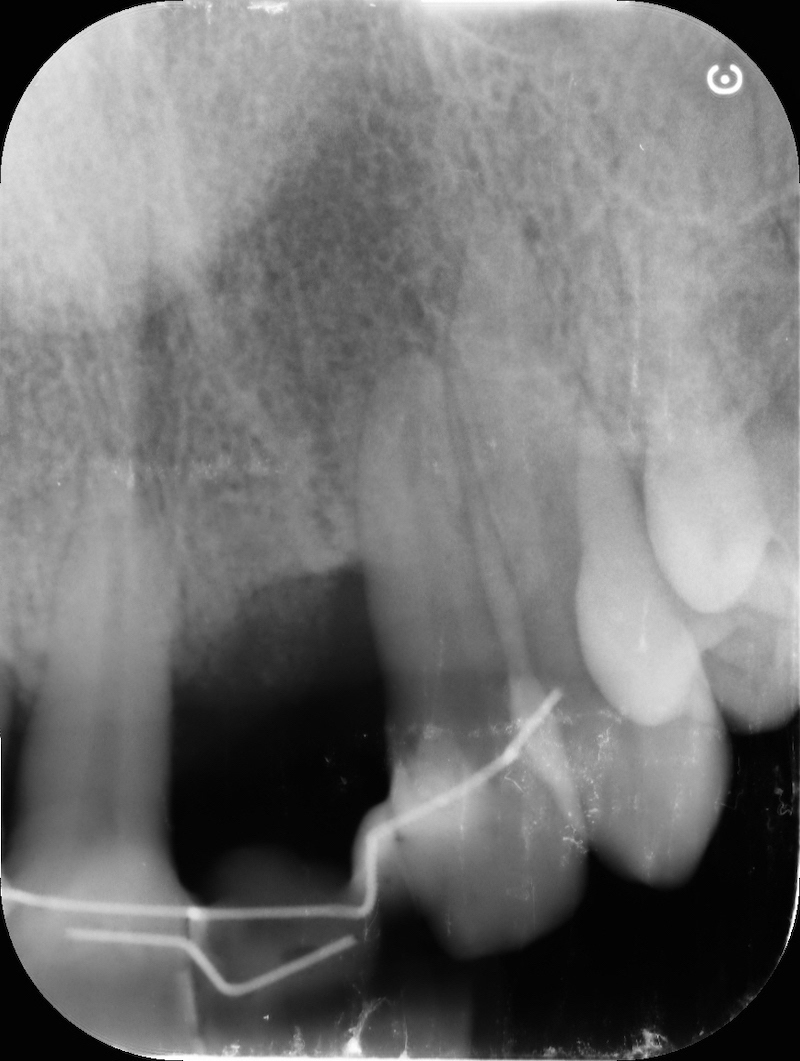
La guarigione ad una settimana


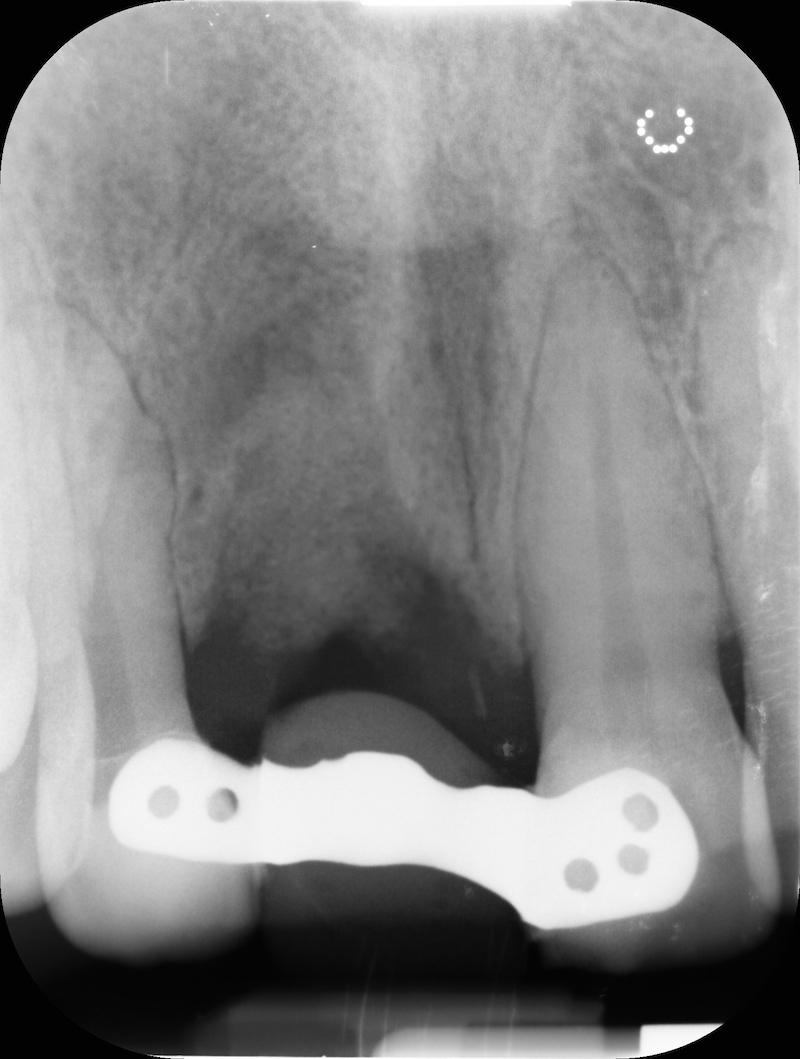
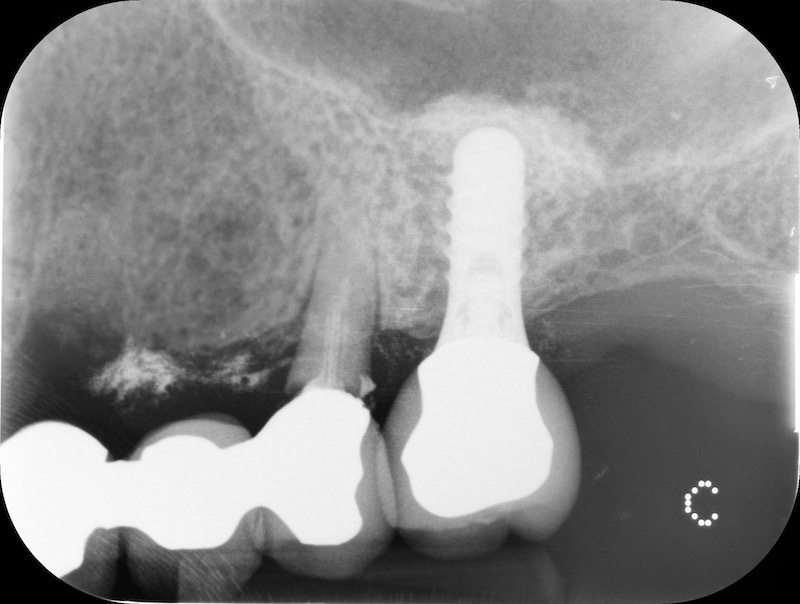
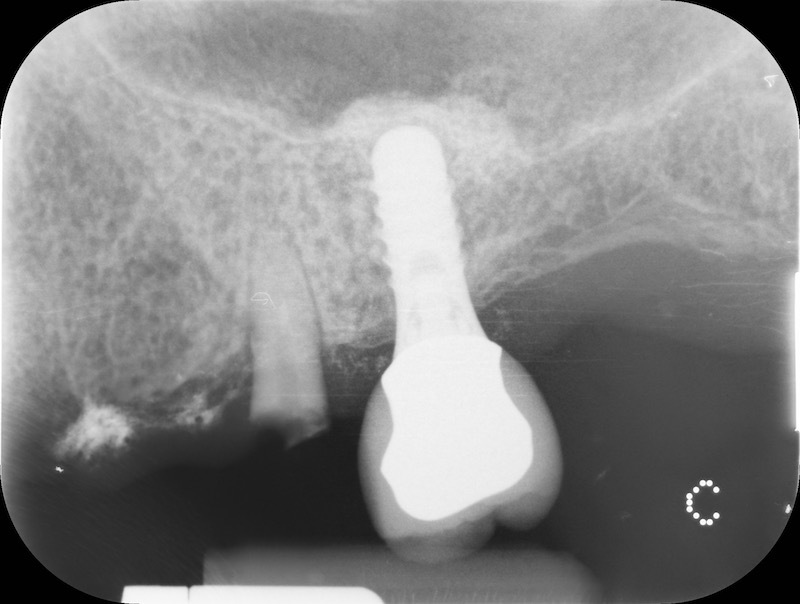
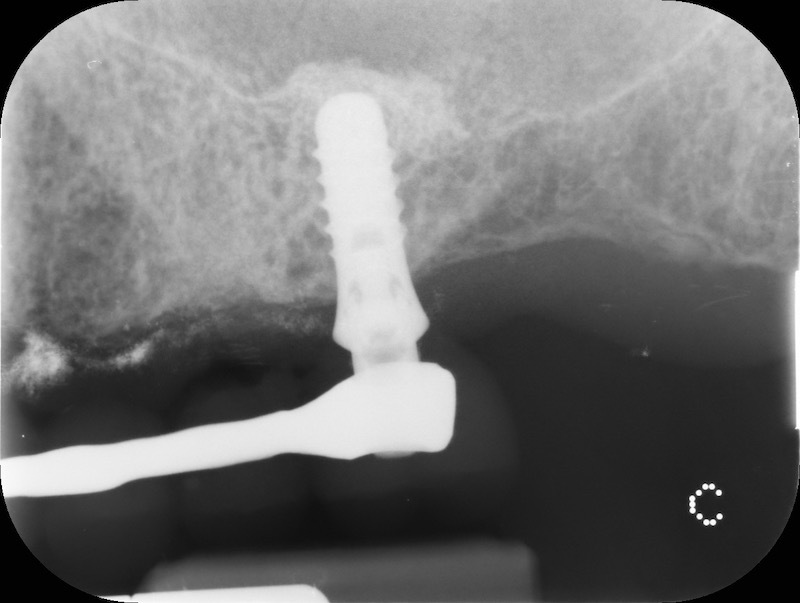
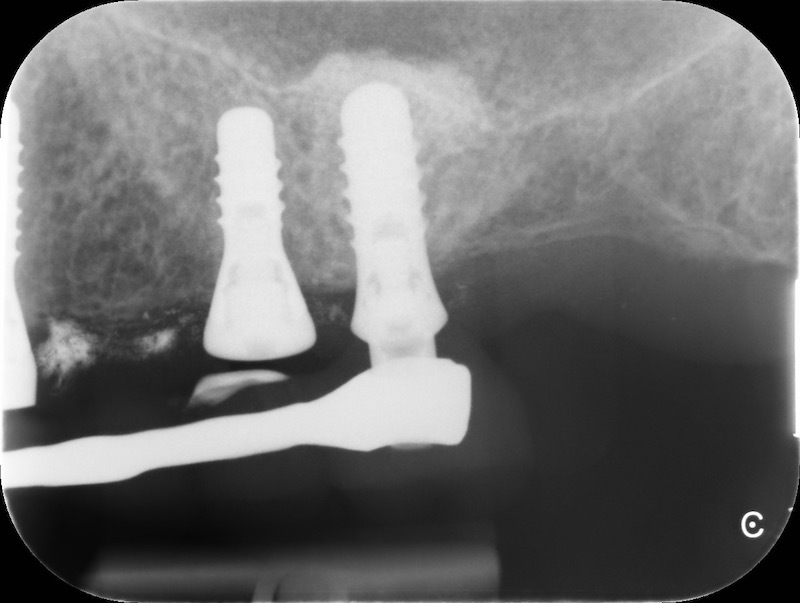
Controllo RX a 13 mesi
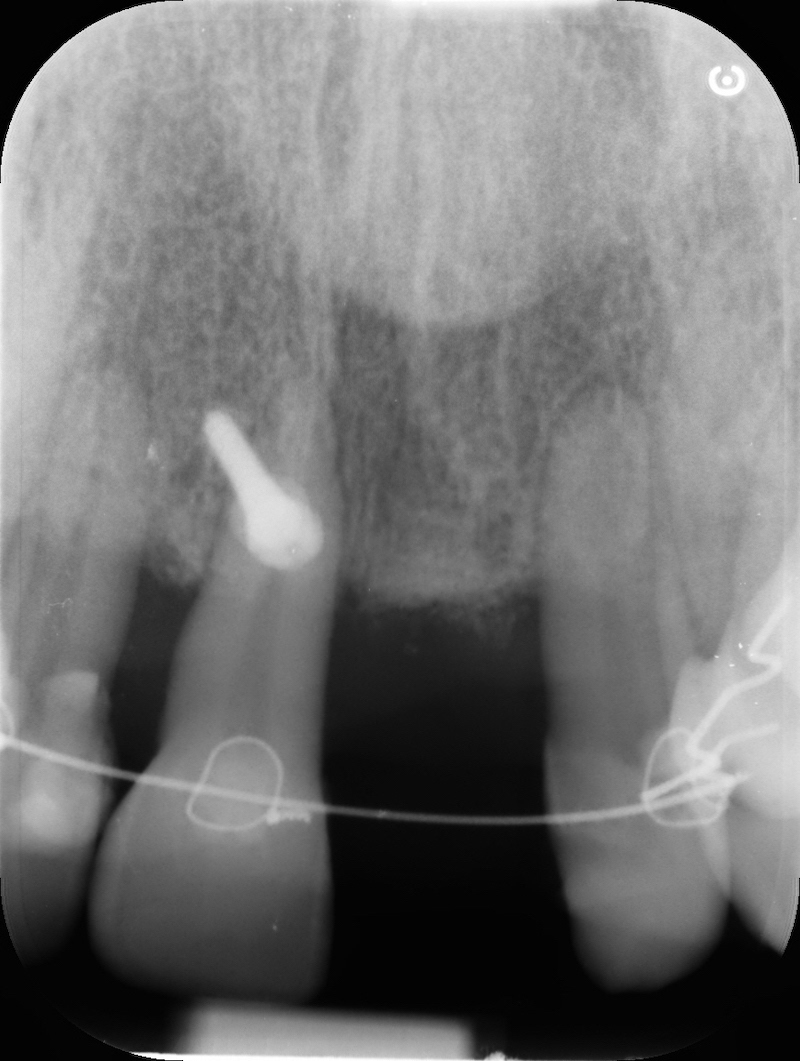
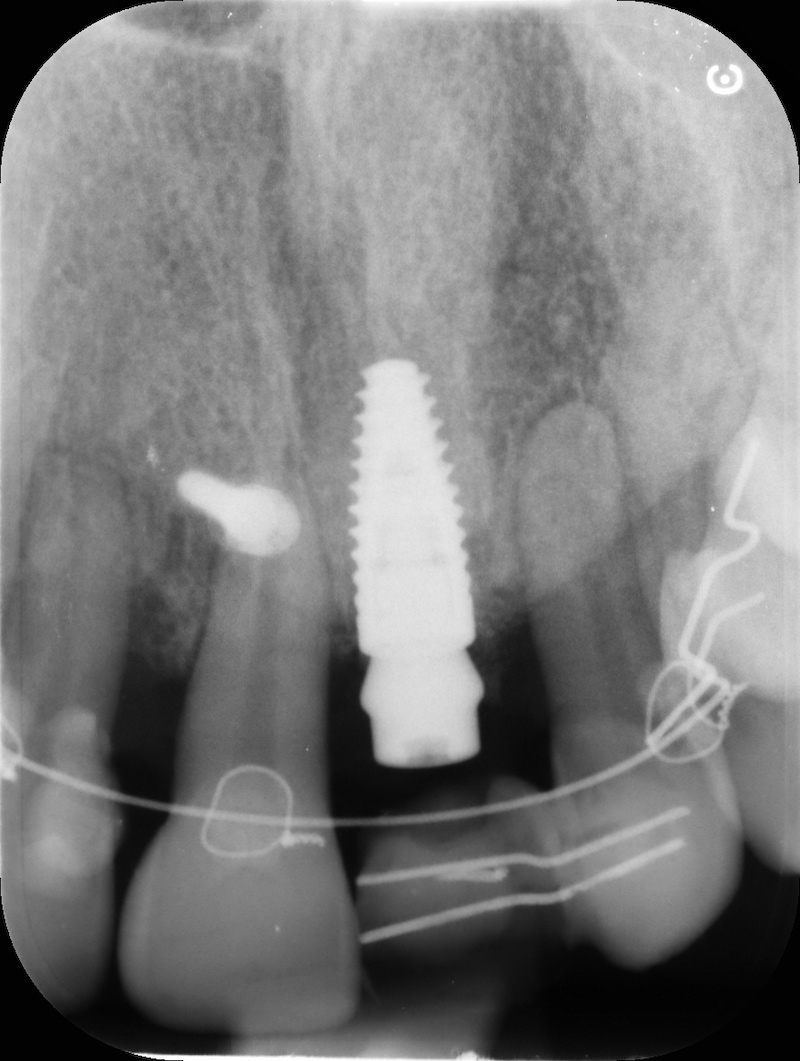
Rx finale con impianto inserito a 14 mesi.
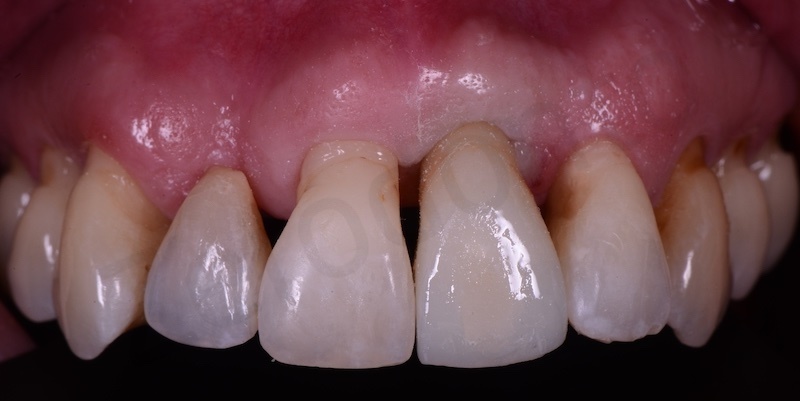
Bio-Oss® collagen + connettivo dal palato
Viene effettuata l’estrazione atraumatica del 12 mediante una leva dritta.
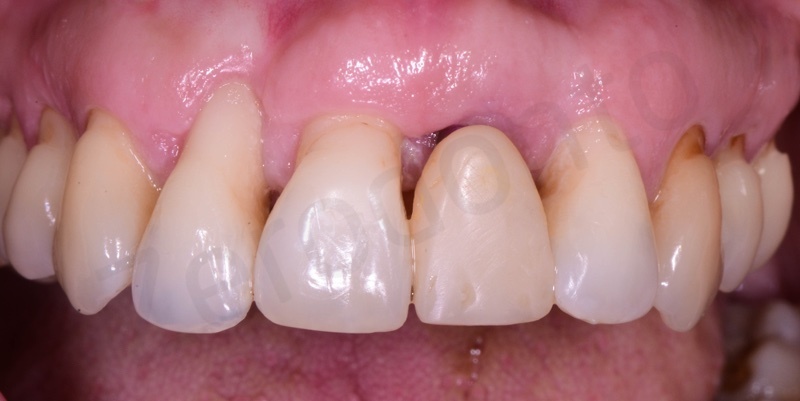
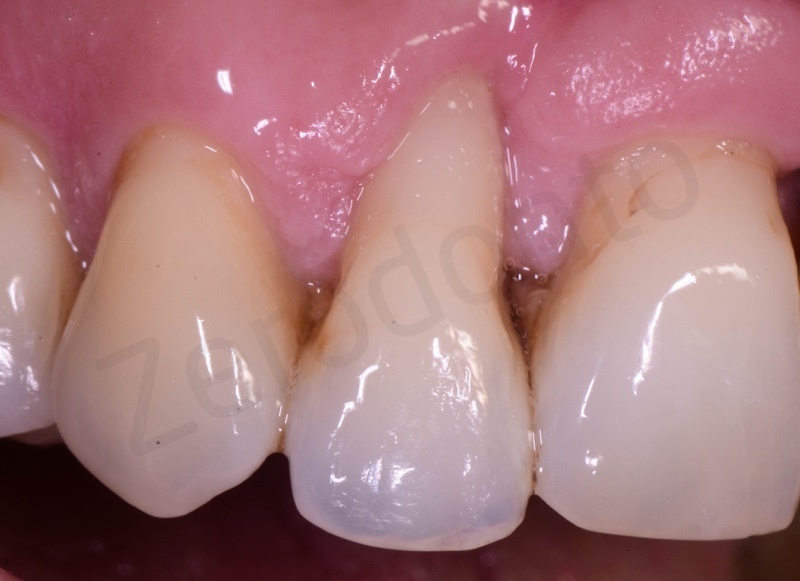

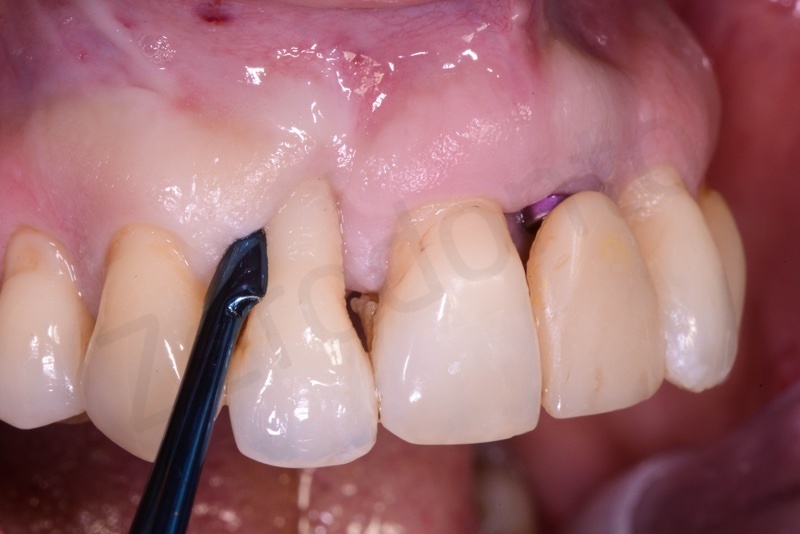
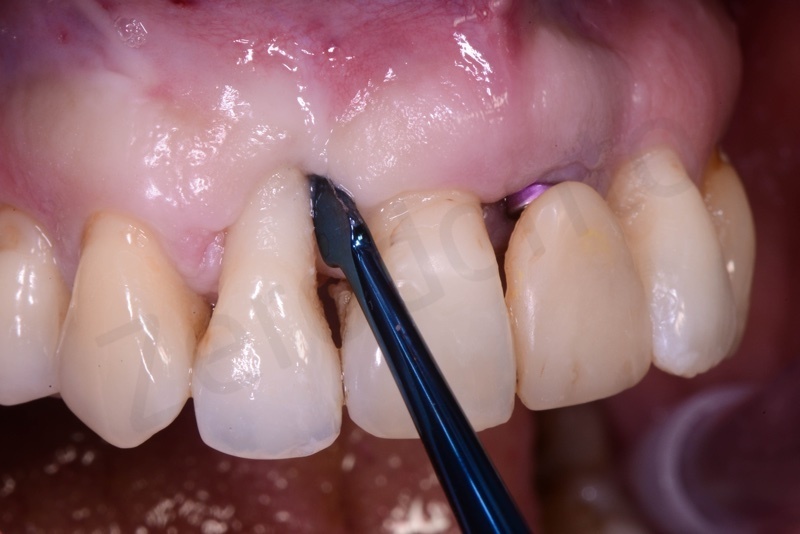
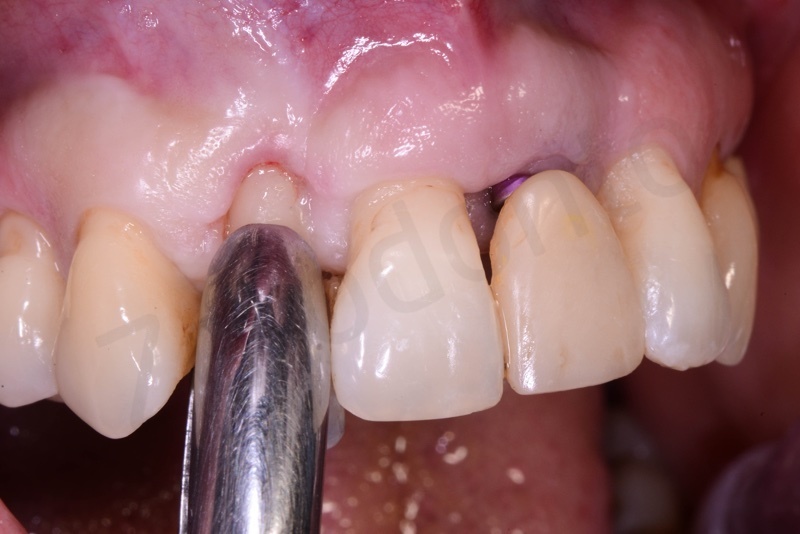
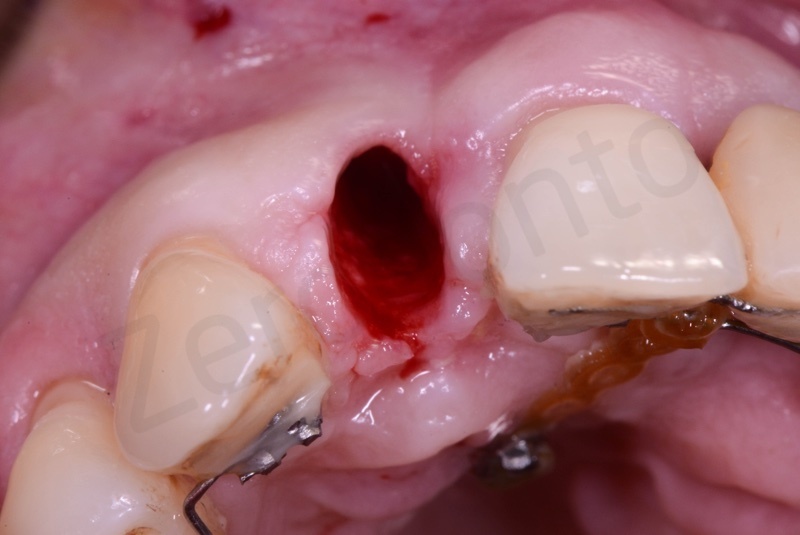
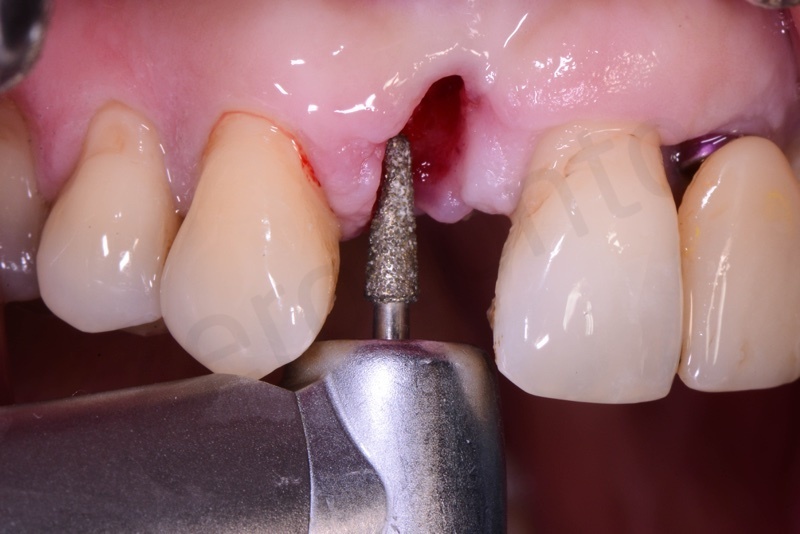
Curettage dell’alveolo post estrattivo al fine di rimuovere il tessuto di granulazione presente.
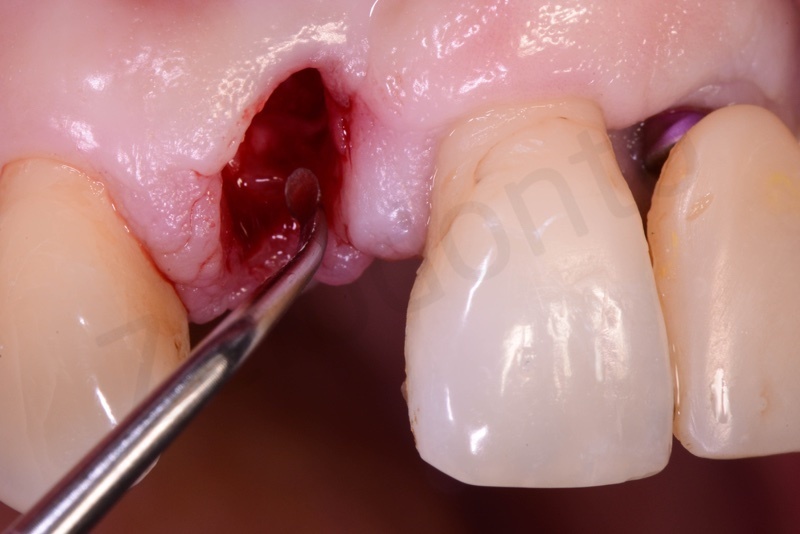
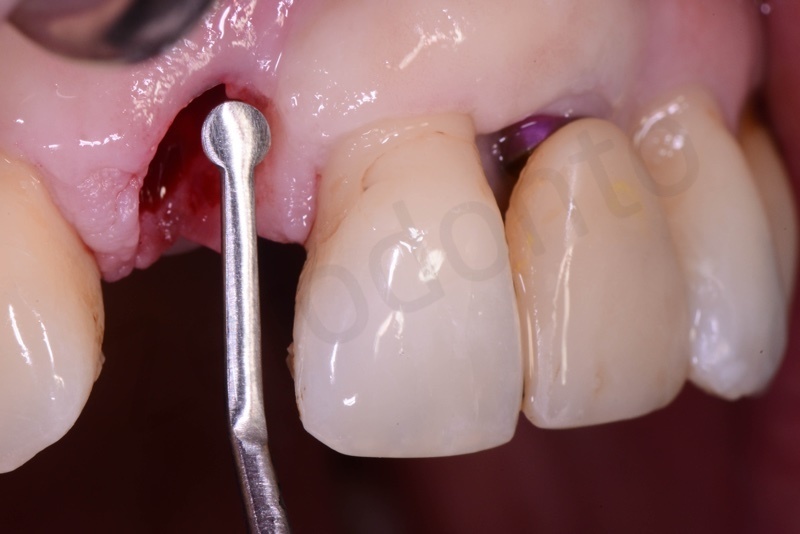
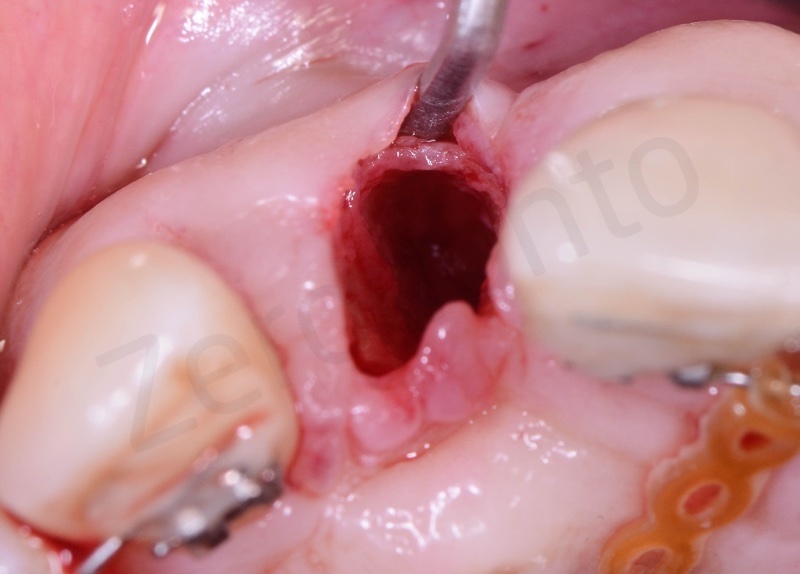
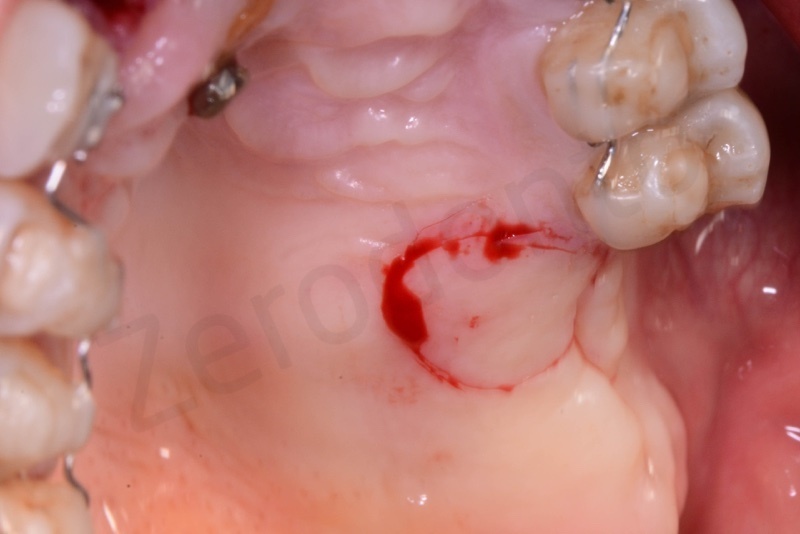
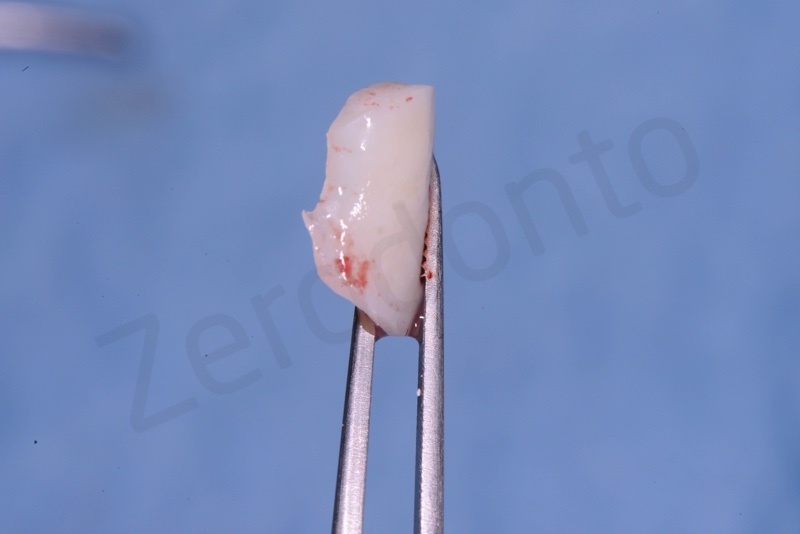
Prelievo di un innesto di tessuto connettivo dal palato in regione 26.
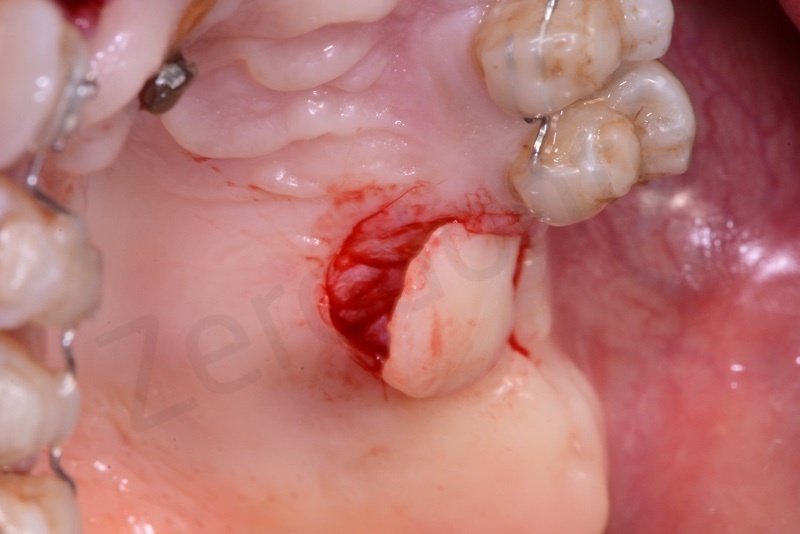
Applicazione di Bio-Oss® collagen.
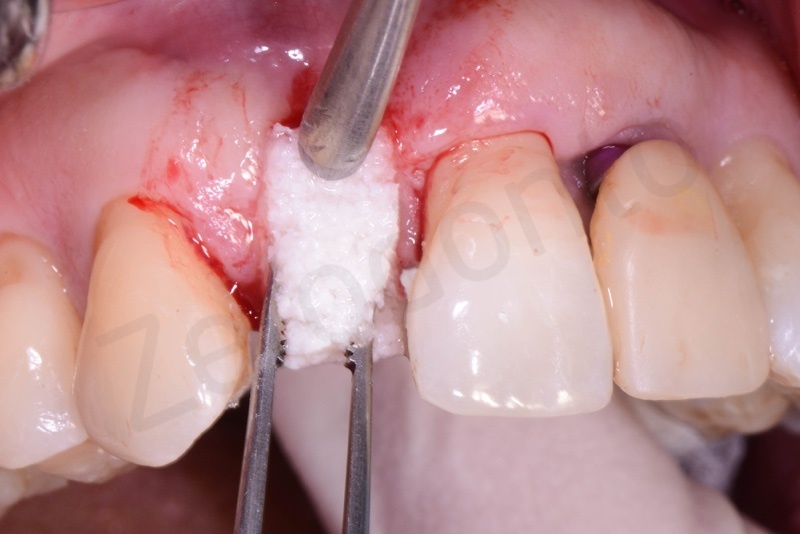
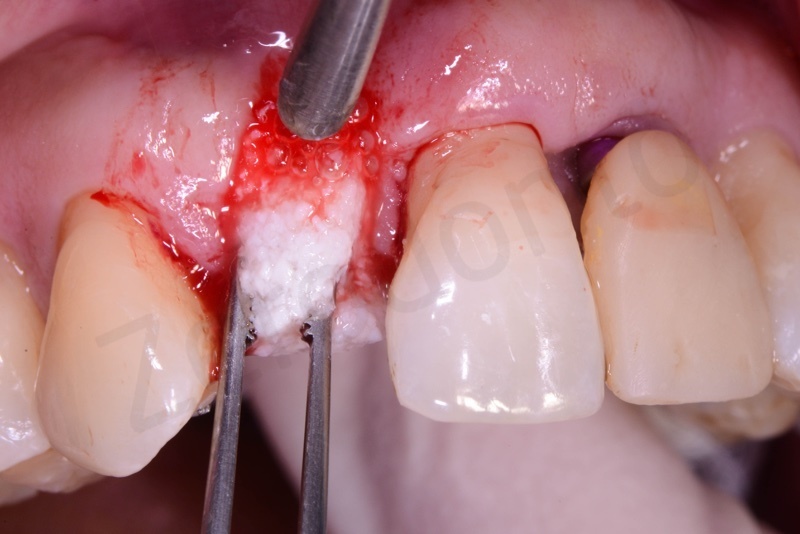
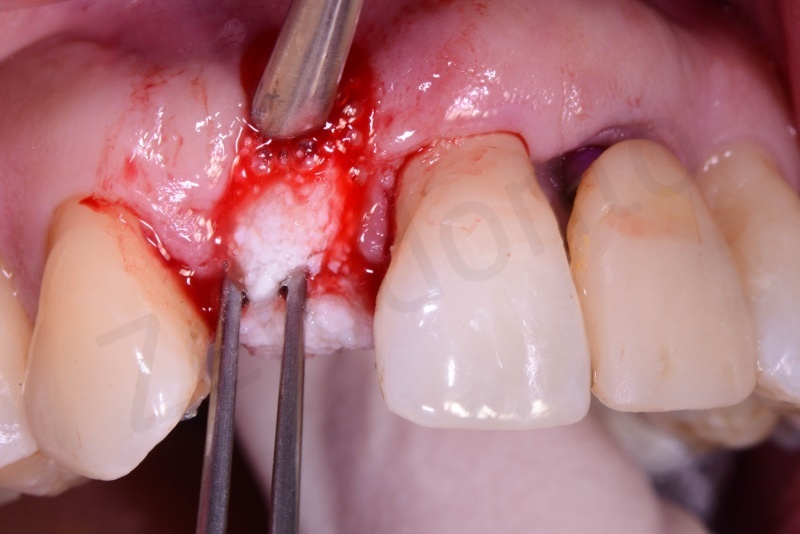
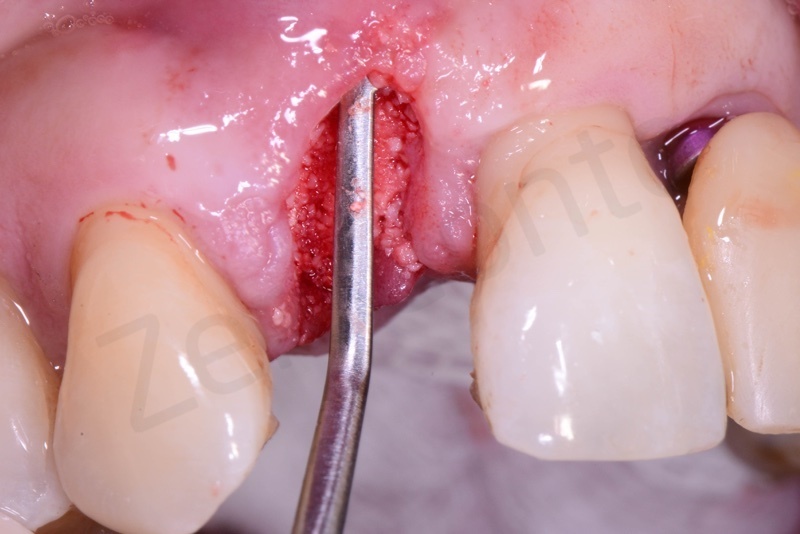
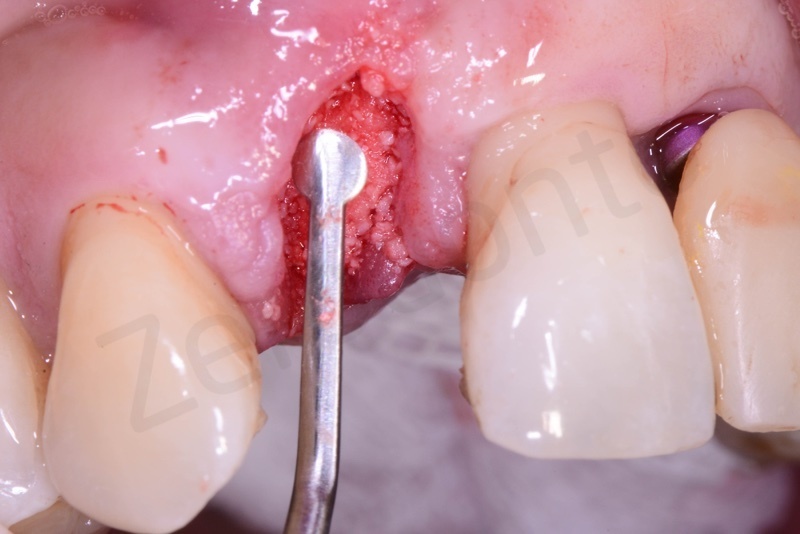
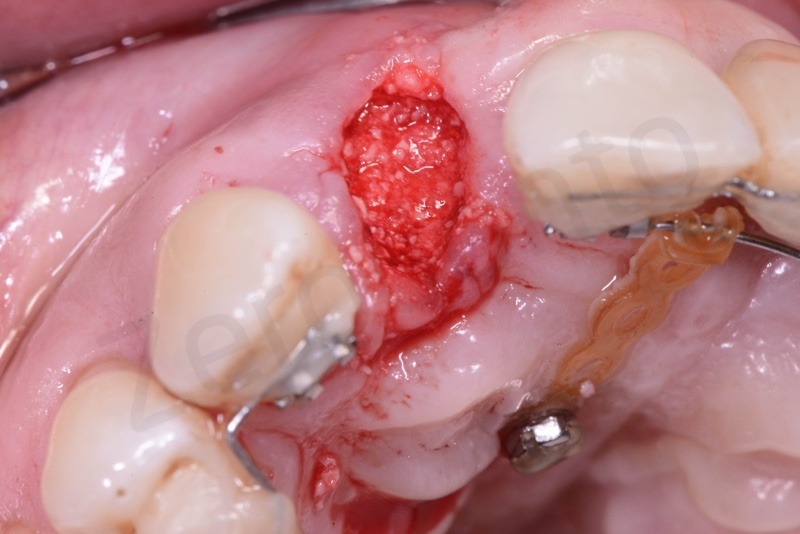
Applicazione del punch di tessuto connettivo disepitelizzato con punti staccati alla gengiva cheratinizzata.
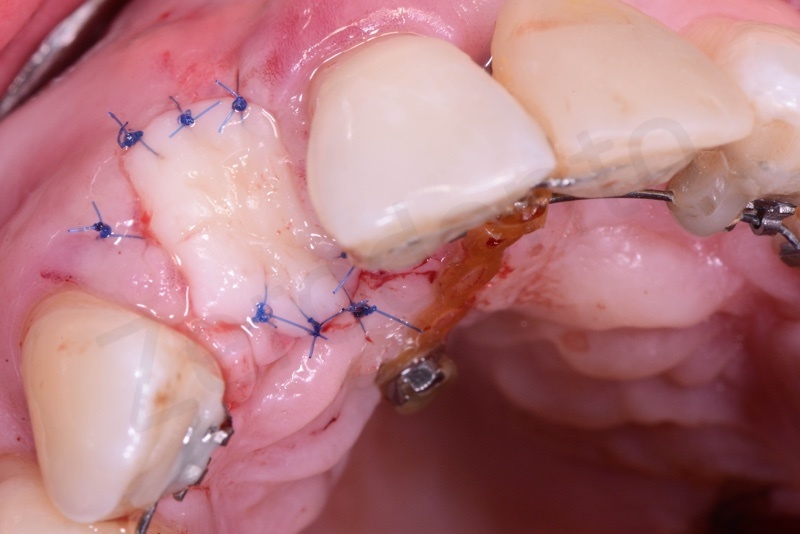
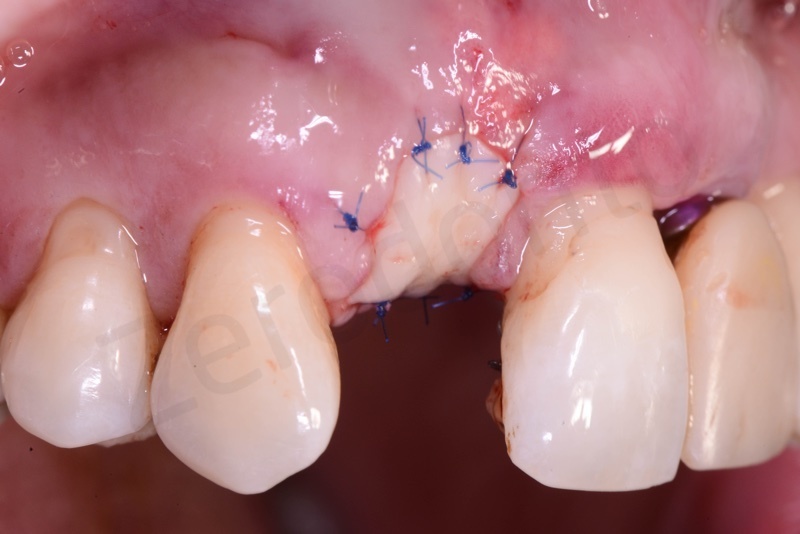
Impianto.
Bio-Oss® collagen + membragel
Membragel. Si tratta di una membrana gel a base di glicol polietilene da applicare con un apposito erogatore per miscelazione diretta di due componenti sintetici, il quale in poco meno di un minuto solidifica stabilizzando i granuli di biomateriale nel loro strato più superficiale.
Nella paziente a cui precedentemente era stata praticata una socket in regione 23 (caso clinico n° due più su in questo articolo), a tre mesi dall’intervento, ci si appresta ad effettuare anche estrazione della radice di 25, con preservazione della cresta in vista di un futuro inserimento impiantare.
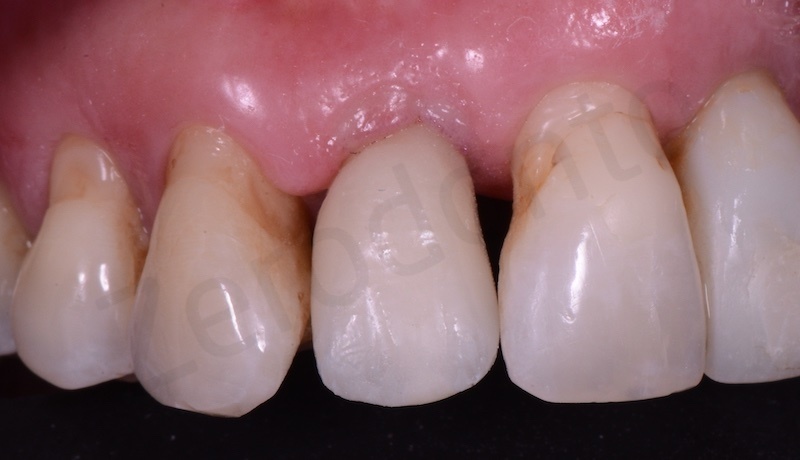
L’aspetto dei tessuti dopo la rimozione del ponte provvisorio
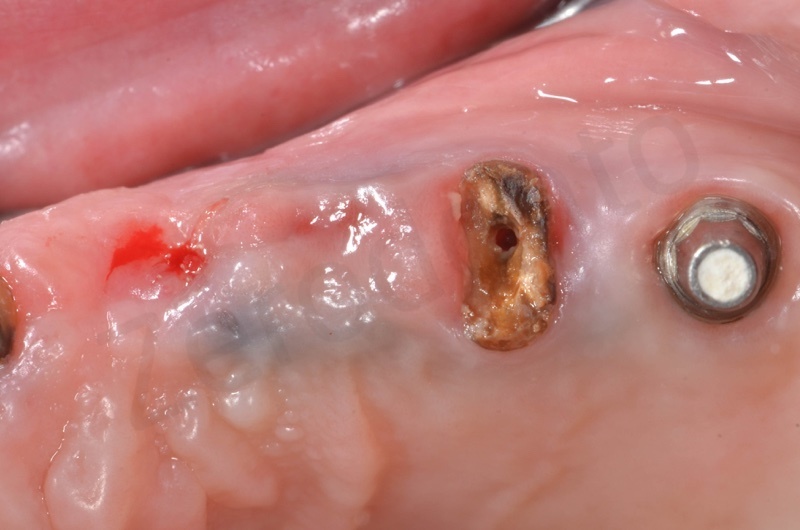
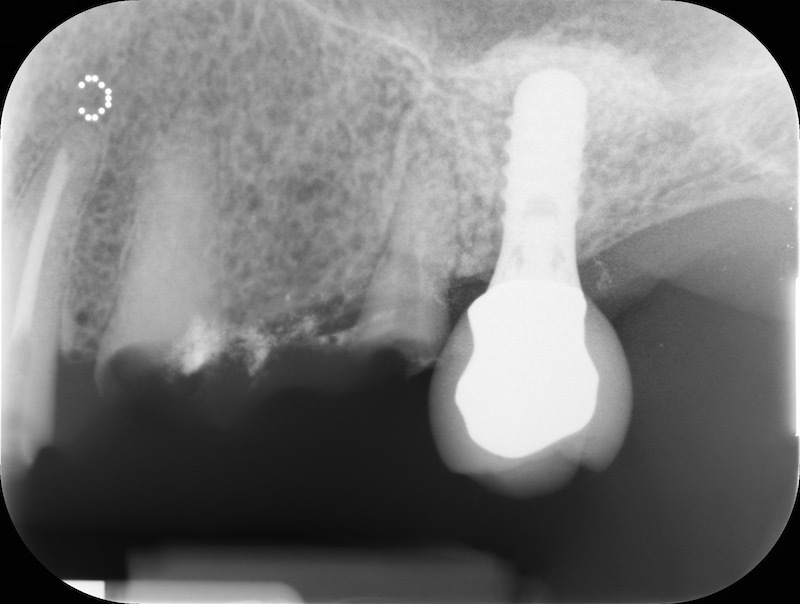
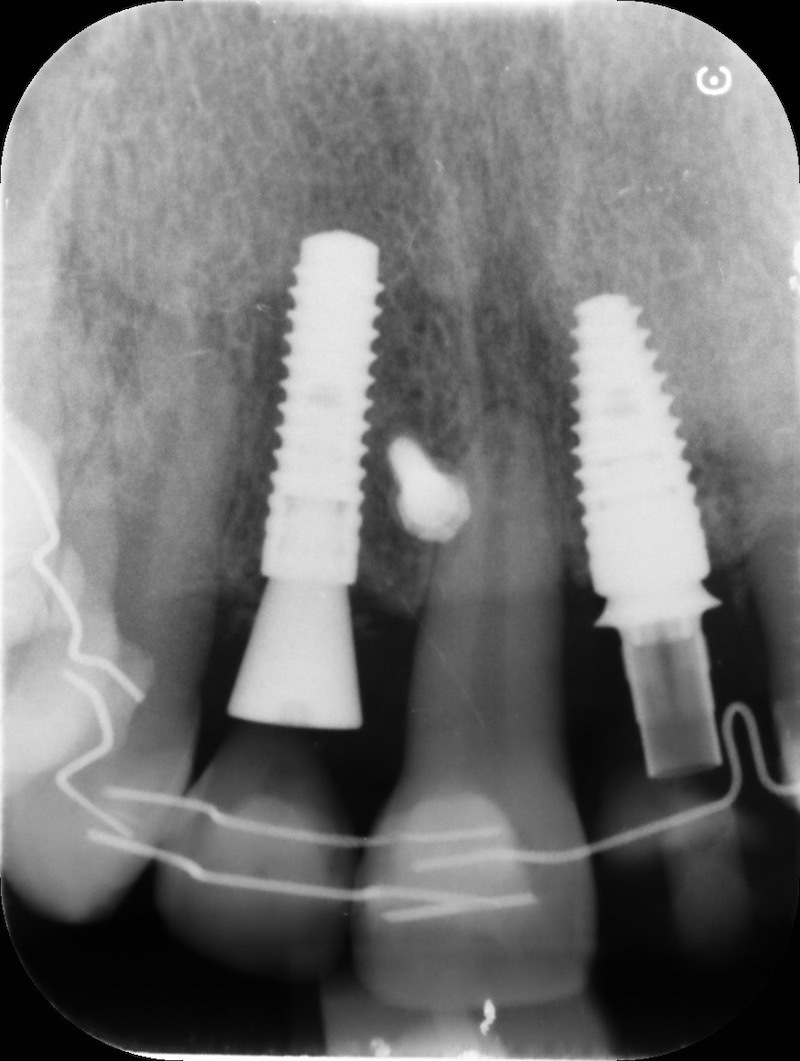
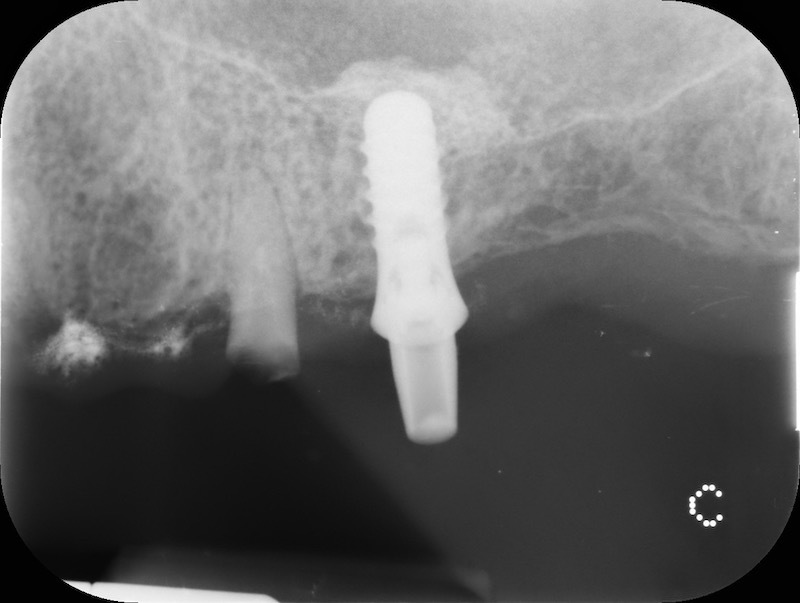
Dalla rx possiamo apprezzare la conservazione della dimensione verticale del sito post estrattivo in regione 23
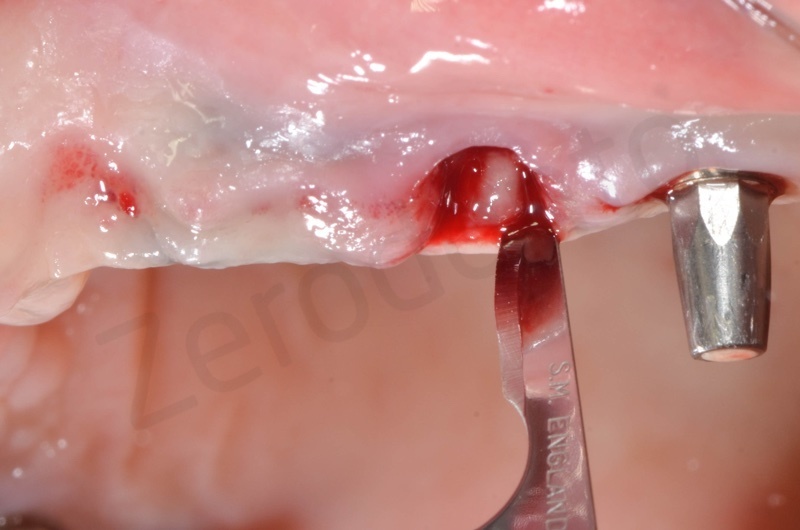
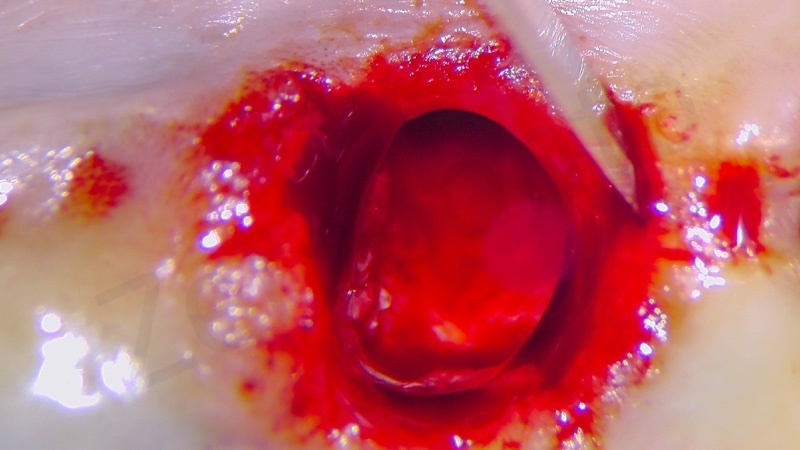
Si esegue l’estrazione della radice del 25
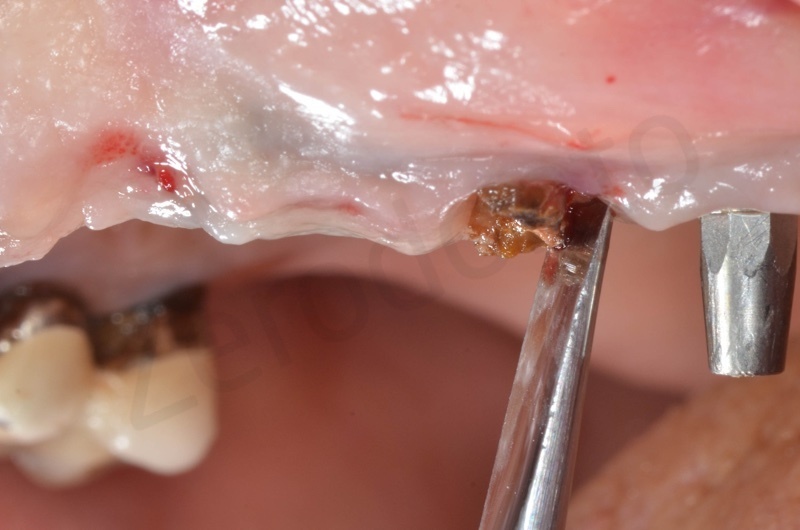
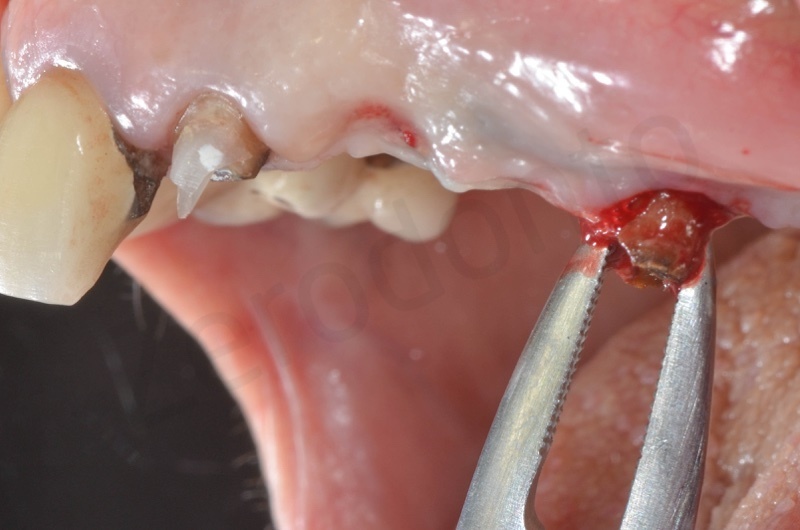
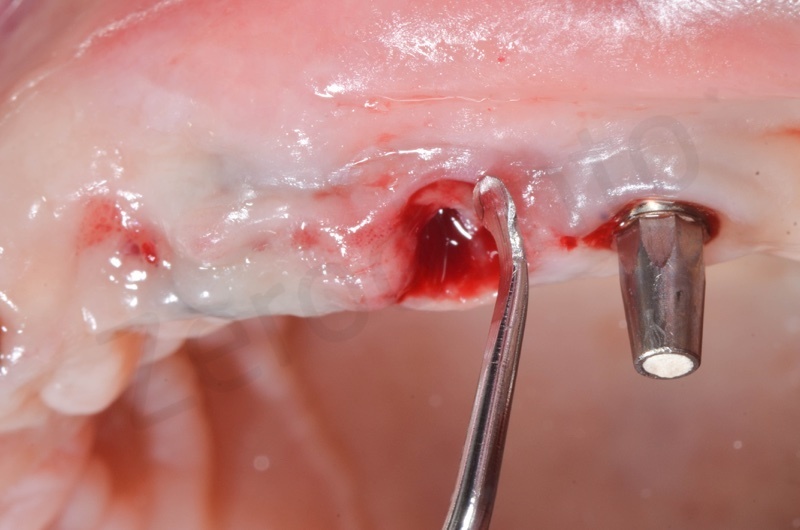
Si procede alla rimozione dell’epitelio del solco e del tessuto di granulazione.
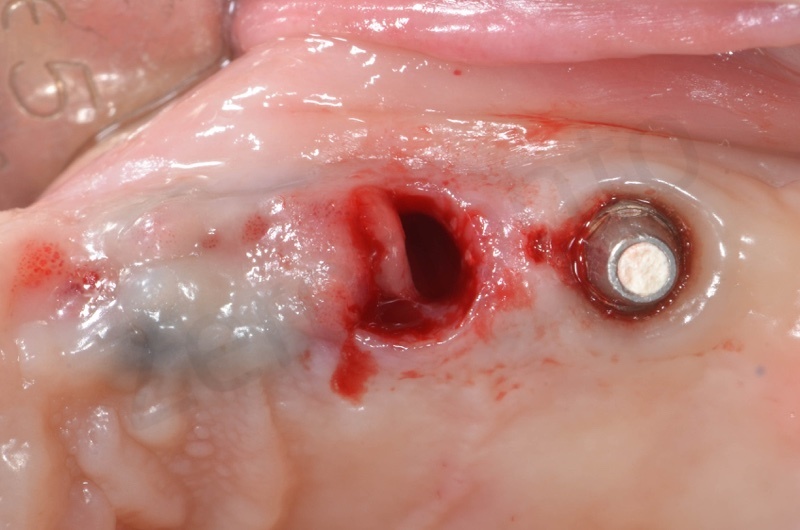
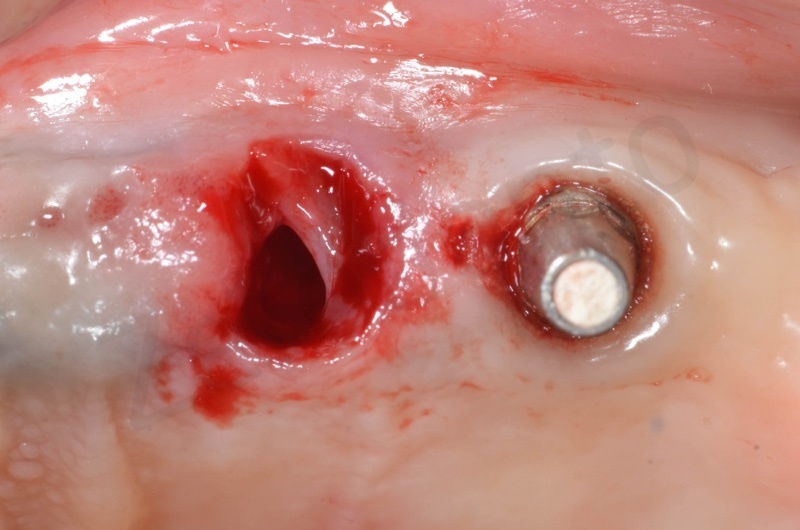
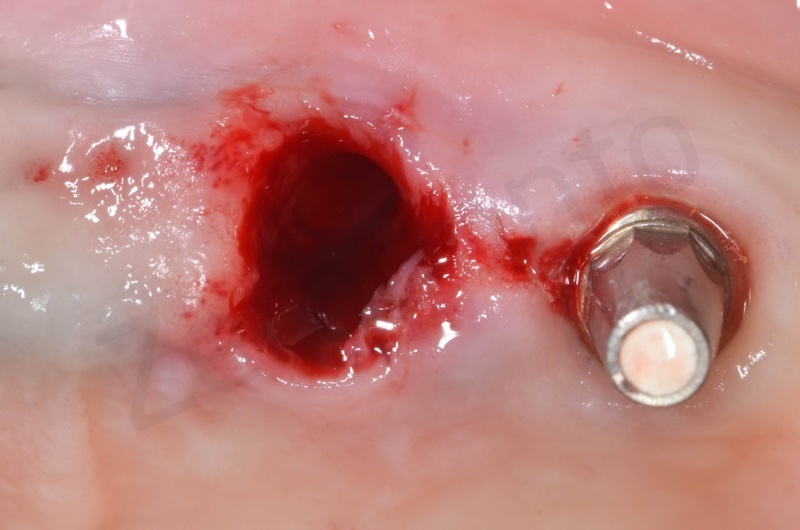
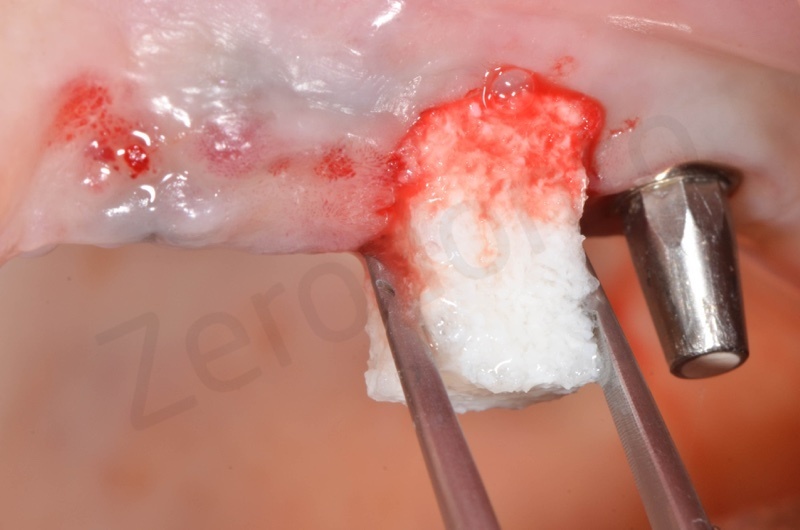
Si inserisce il bioss collagen precedentemente idratato in soluzione fisiologica
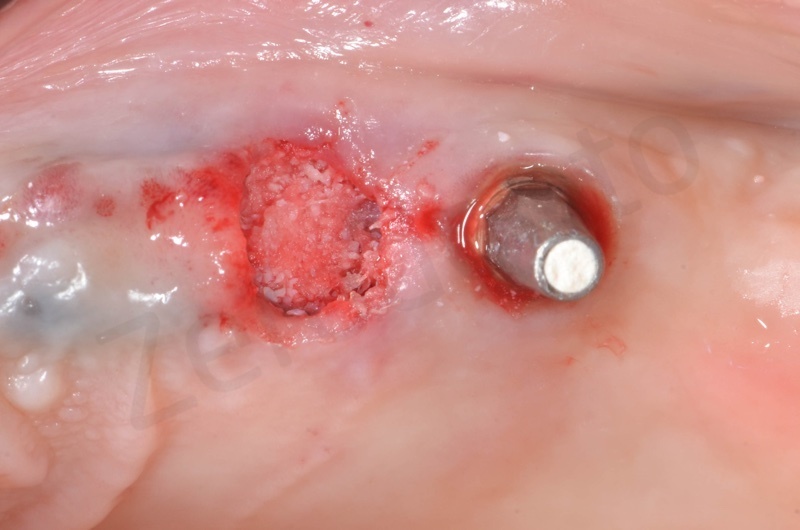
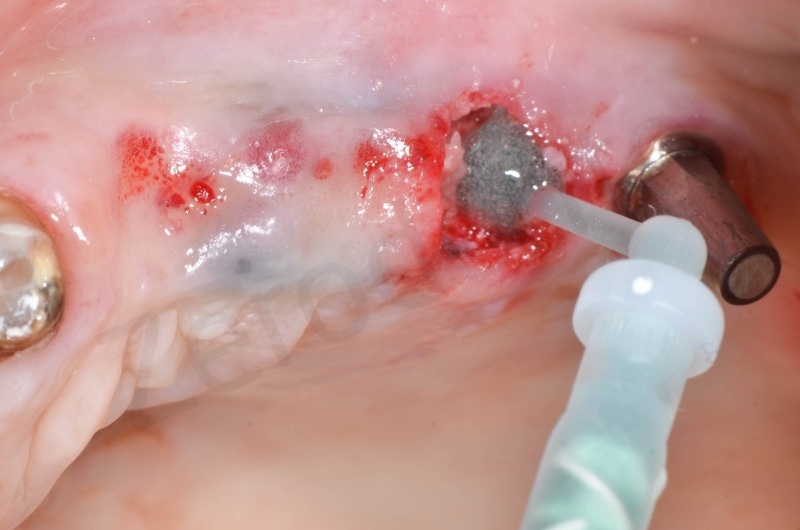
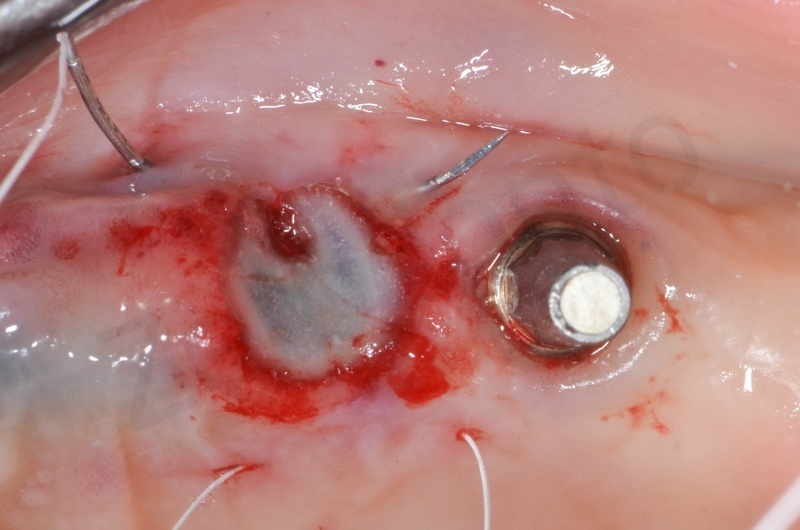
Il membragel viene applicato direttamente in sito mediante una particolare siringa per miscelazione diretta di 2 componenti sintetici a base di PEG (glicole polietilenico)

A 20-50 secondi dall’applicazione il membrane solidifica assumendo una consistenza simile a quella dei siliconi da impronta, adattandosi al sito con effetto barriera.
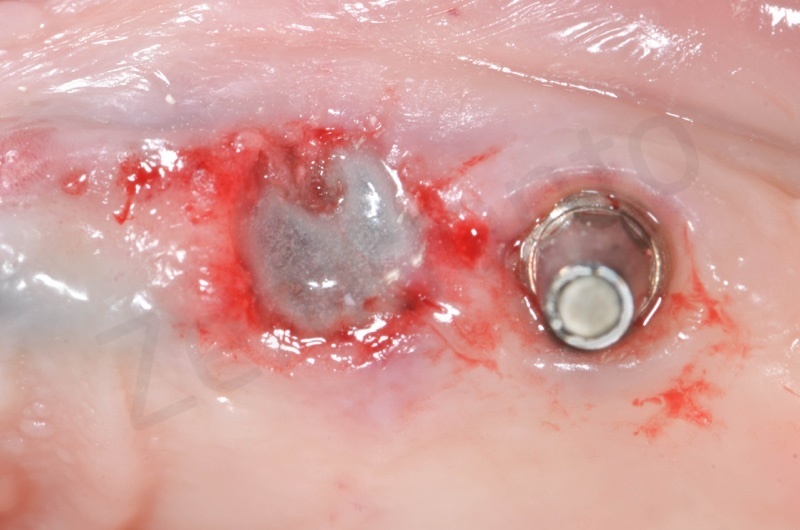
Per una maggiore stabilità viene anche effettuata una sutura a materassaio incrociato
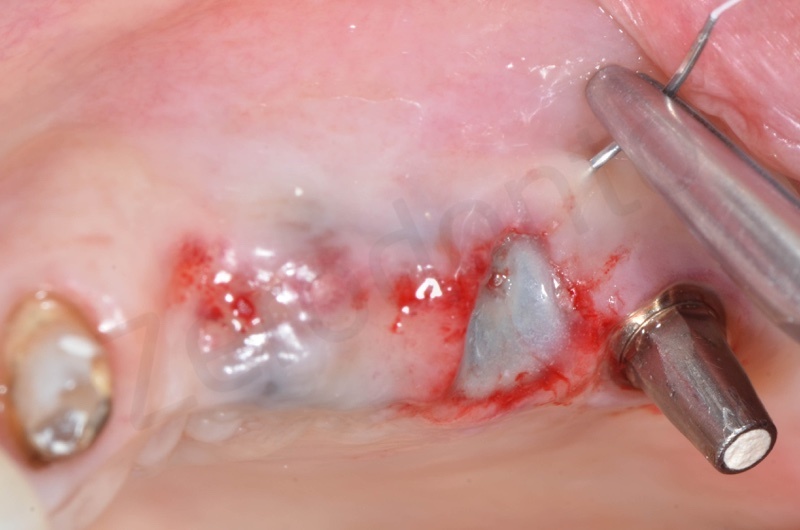
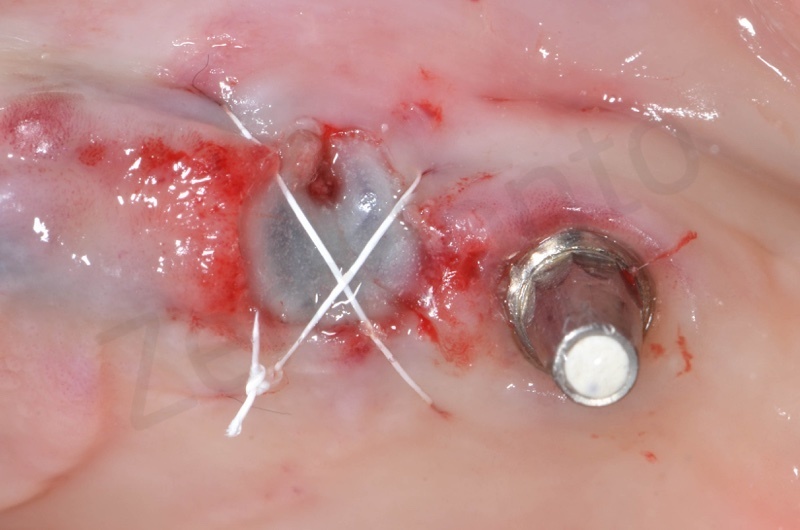
Successivamente viene posizionato il ponte provvisorio su impianti
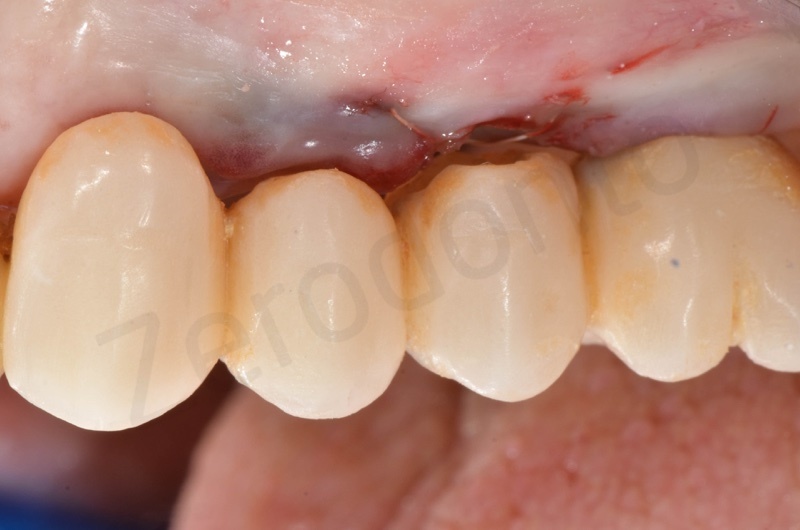

Ad una settimana possiamo apprezzare già la maturazione della gengiva che si presenta rosa corallo e priva di infiammazione. Il membragel ha assunto l’aspetto di un’escara.
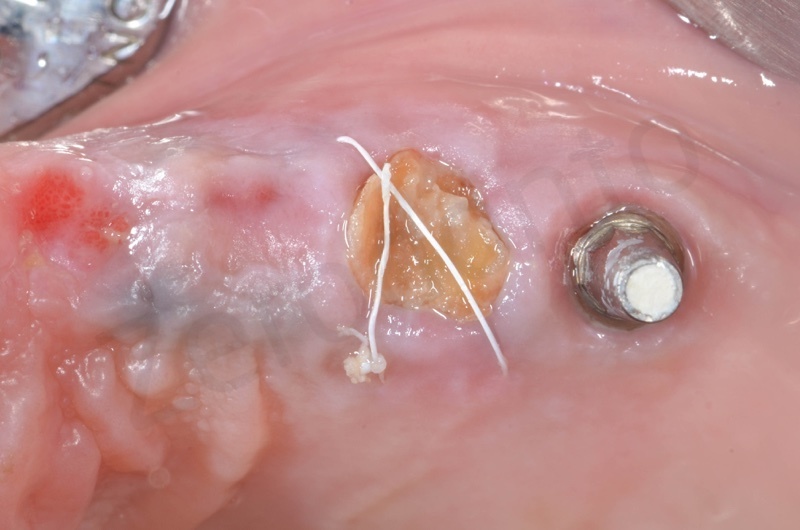
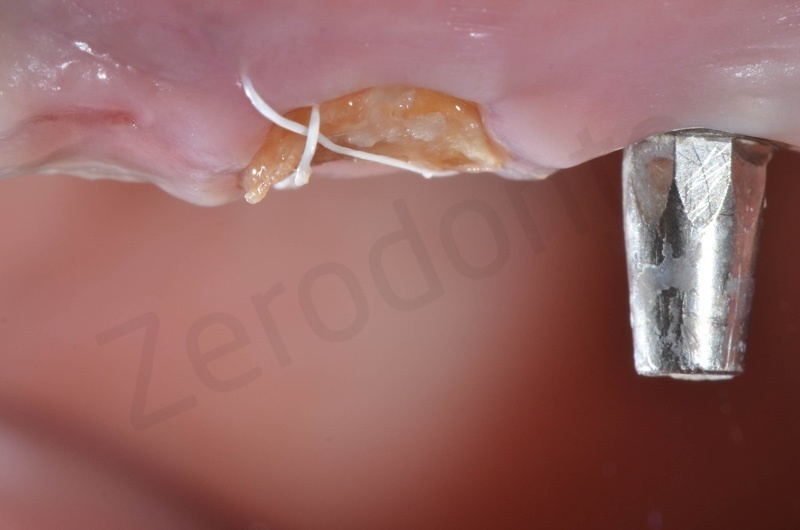
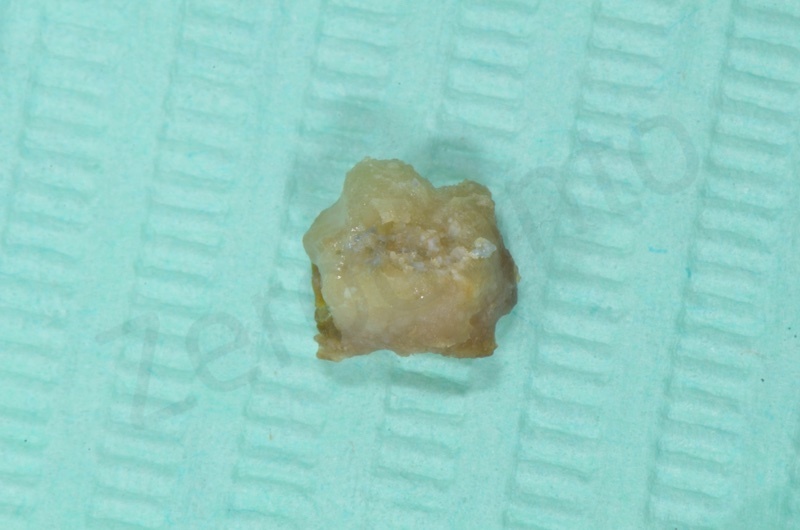
A due settimane dall’intervento il membragel ormai distaccato dai tessuti sottostanti viene rimosso
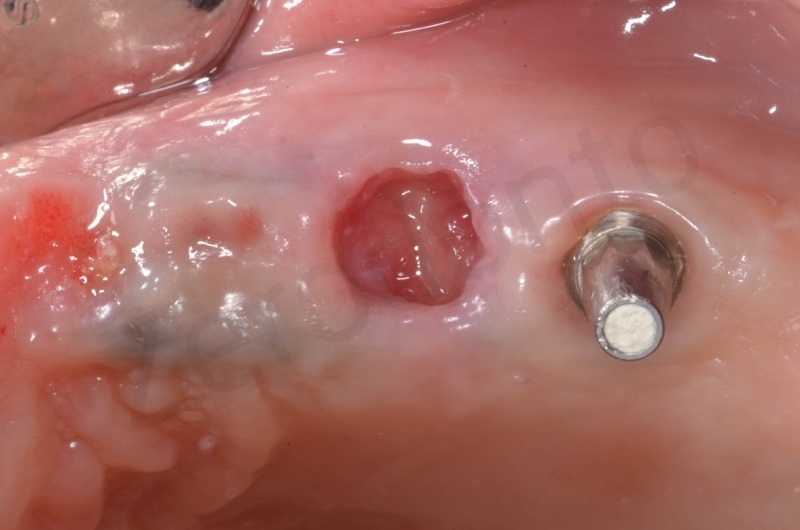
Particolare del sito post-estrattivo in cui si apprezza la guarigione dei tessuti a due settimane
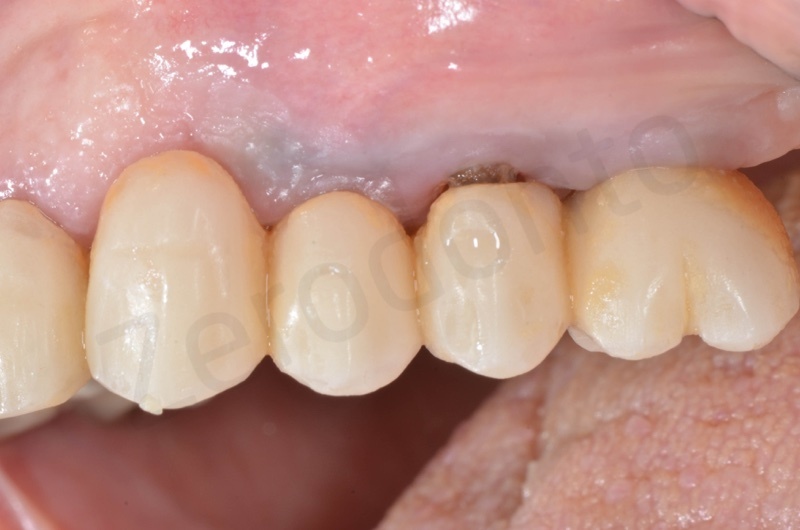
Il sito a due mesi dall’intervento
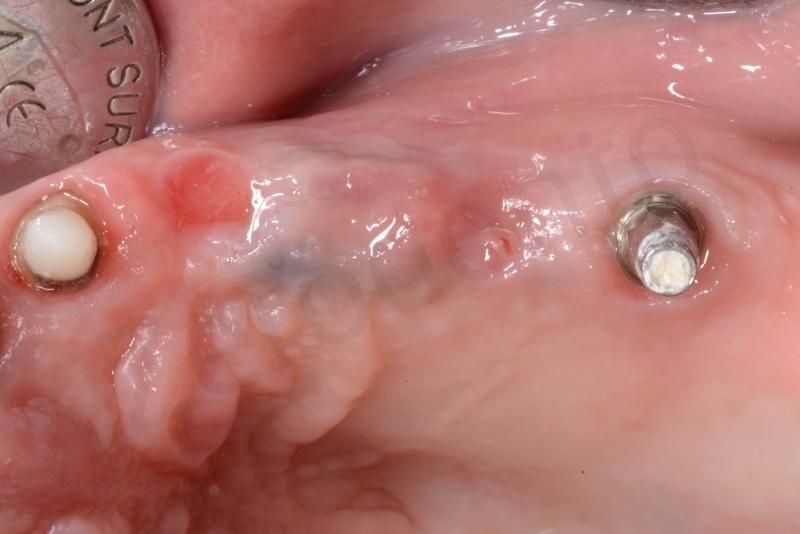
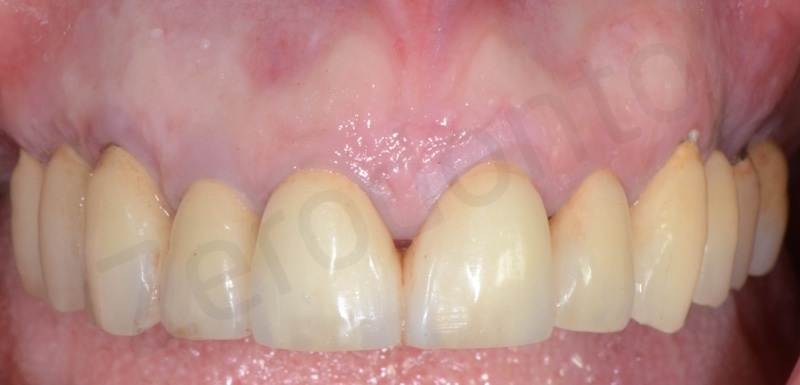
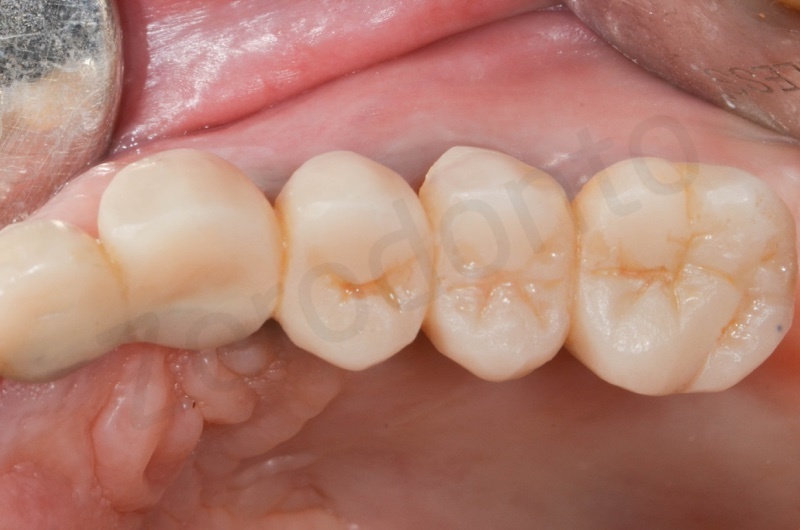
La finalizzazione del caso a due anni, con l’inserimento di due impianti in regione 23 e 25

CONCLUSIONI
Finora nessuna tecnica è ancora riuscita nell’intento di preservare completamente la cresta e ancora non disponiamo di un materiale ideale per la socket. La socket ha comunque un valore nel limitare il riassorbimento osseo.
Da un punto di vista clinico, secondo la nostra esperienza, l’utilizzo dell’innesto di connettivo determina una guarigione migliore dei tessuti nelle settimane successive all’intervento. Il Membragel, invece, è il materiale che ci è sembrato, da un punto di vista clinico, meno performante. L’utilizzo della Mucograft ci è sembrata la soluzione migliore considerando il fatto che si evita il prelievo di tessuto connettivo, riducendo quindi la morbilità del paziente.
BIBLIOGRAFIA
Araujo, M.G. & Lindhe, J. (2005) Dimensional ridge alterations following tooth extraction: an experi- mental study in the dog. Journal of Clinical Peri- odontology 32: 212–218.
Atwood, D. A. (1962) Some clinical factors related to the rate of resorption of residual ridges. Journal of Prosthetic Dentistry 12, 441–450.
Cardaropoli, G., Arau ́jo, M. & Lindhe, J. (2003) Dynamics of bone tissue formation in tooth extraction sites. An experimental study in dogs. Journal of Clinical Periodontology 30, 809–818.
Vignoletti, F., Matesanz, P., Rodrigo, D., Figuero, E., Martin, C. & Sanz, M. (2012) Surgical proto- cols for ridge preservation after tooth extraction. A systematic review. Clinical Oral Implants Research 23(Suppl. 5): 22–38.
Barone, A., Orlando, B., Cingano, L., Marconcini, S., Derchi, G. & Covani, U. (2012) A randomised clinical trial to evaluate and compare implants placed in augmented vs. non-augmented extrac- tion sockets: a 3-year evaluation. Journal of Peri- odontology 83: 836–846.
Barone, A., Ricci, M., Tonelli, P., Santini, S. & Covani, U. (2013) Tissue changes of extraction sockets in humans. A comparison of spontaneous healing vs. ridge preservation with secondary soft tissue healing. Clinical Oral Implants Research 24: 1231–1237.
Barone, A., Toti, P., Piattelli, A., Iezzi, G., Derchi, G. & Covani, U. (2014) Extraction socket healing in humans after ridge preservation techniques: a comparison between flapless and flapped proce- dure in a randomised clinical trial. Journal of Periodontology 85: 14–23.
Cardaropoli, D. & Cardaropoli, G. (2008) Preserva- tion of the postextraction alveolar ridge. A clini- cal and histologic study. The International Journal of Periodontics & Restorative Dentistry 28: 469–477.
Fickl, S., Zuhr, O., Wachtel Bolz, W. & Hu€rzeler, M.B. (2008b) Tissue alteration after tooth extrac- tion with and without surgical trauma: a volu- metric study in beagle dog. Journal of Clinical Periodontology 35: 356–363.
Fickl, S., Zuhr, O., Wachtel, H., Stappert, C.F.J., Stein, J.M. & Hu€rzeler, M.B. (2008a) Dimensional changes of the alveolar ridge contour after differ- ent socket preservation techniques. Journal of Clinical Periodontology 35: 906–913.
Schropp, L., Wenzel, A., Kostopoulos, L. & Karring, T. (2003) Bone healing and soft tissue contour changes following single-tooth extraction: a clini- cal and radiographic 12-month prospective study. The International Journal of Periodontics & Restorative Dentistry 23: 313–323.
Schropp, L., Kostopoulos, L., Wenzel, A. & Isidor, F. (2005) Clinical and radiographic performance of delayed-immediate single- tooth implant placement associated with peri-implant bone defects. A 2-year prospec- tive, controlled, randomized follow-up report. Journal of Clinical Periodontology 32, 480– 487.
Arau ́ jo, M., Linder, E., Wennstro ̈ m, J. & Lindhe, J. (2008) The influence of Bio-Oss Collagen on healing of an extraction socket: an experimental study in the dog. Interna- tional Journal of Periodontics and Restora- tive Dentistry 28, 123–135.
Jung, R. E., Siegenthaler, D. W. & Hammerle, C. H. (2004) Postextraction tissue manage- ment: a soft tissue punch technique. Interna- tional Journal of Periodontics and Restorative Dentistry 24, 545–553.
Carmagnola, D., Adriaens, P. & Berglundh, T. (2003) Healing of human extraction sockets filled with Bio-Oss. Clinical Oral Implants Research 14, 137–143.
Cardaropoli, M. Arau ́ jo, R. Hayacibara, F. Sukekava, and J. Lindhe, “Healing of extraction sockets and surgically pro- duced—augmented and non-augmented—defects in the al- veolar ridge. An experimental study in the dog,” Journal of Clinical Periodontology, vol. 32, no. 5, pp. 435–440, 2005.
C. H. Hammerle, M. G. Araujo, and M. Simion, “Evidence- based knowledge on the biology and treatment of extraction sockets,” Clinical Oral Implants Research, vol. 23, supplement 5, pp. 80–82, 2012.
M. Araùjo, E. Linder, and J. Lindhe, “Effect of a xenograft on early bone formation in extraction sockets: an experimental study in dog,” Clinical Oral Implants Research, vol. 20, no. 1, pp. 1–6, 2009.
S.Fickl, D.Schneider,O.Zuhretal.,“Dimensionalchangesof the ridge contour after socket preservation and buccal over- building: an animal study,” Journal of Clinical Periodontology, vol. 36, no. 5, pp. 442–448, 2009.
D. Botticelli, T. Berglundh, D. Buser, and J. Lindhe, “The jumping distance revisited: an experimental study in the dog,” Clinical Oral Implants Research, vol. 14, no. 1, pp. 35– 42, 2003.
D. Botticelli, T. Berglundh, and J. Lindhe, “Resolution of bone defects of varying dimension and configuration in the marginal portion of the peri-implant bone: an experimental study in the dog,” Journal of Clinical Periodontology, vol. 31, no. 4, pp. 309–317, 2004.
M.G.Arau ́jo,J.L.Wennstro ̈m,andJ.Lindhe,“Modeling of the buccal and lingual bone walls of fresh extraction sites following implant installation,” Clinical Oral Implants Research, vol. 17, no. 6, pp. 606–614, 2006.
D. Botticelli, L. G. Persson, J. Lindhe, and T. Berglundh, “Bone tissue formation adjacent to implants placed in fresh extraction sockets: an experimental study in dogs,” Clinical Oral Implants Research, vol. 17, no. 4, pp. 351–358, 2006.
G. Cardaropoli, M. Arau ́ jo, R. Hayacibara, F. Sukekava, and
J. Lindhe, “Healing of extraction sockets and surgically pro- duced—augmented and non-augmented—defects in the al- veolar ridge. An experimental study in the dog,” Journal of Clinical Periodontology, vol. 32, no. 5, pp. 435–440, 2005.
C. H. Hammerle, M. G. Araujo, and M. Simion, “Evidence- based knowledge on the biology and treatment of extraction sockets,” Clinical Oral Implants Research, vol. 23, supplement 5, pp. 80–82, 2012.
F. Vignoletti, P. Matesanz, D. Rodrigo, E. Figuero, C. Martin, and M. Sanz, “Surgical protocols for ridge preservation after tooth extraction. A systematic review,” Clinical Oral Implants Research, vol. 23, supplement 5, pp. 22–38, 2012.
Barone A, Ricci M, Tonelli P, Santini S. Covani U. Tissue changes of extraction sockets in humans: a comparison of spontaneous healing vs. ridge preservation with secondary soft tissue healing. Clin. Oral Impl. Res. 24, 2013, 1231–1237 doi: 10.1111/j.1600-0501.2012.02535.x
Engler-Hamm, D., Cheung, W.S., Yen, A., Stark, P.C. & Griffin, T. (2011) Ridge preservation using a composite bone graft and a bioabsorbable mem- brane with and without primary wound closure: a comparative clinical trial. Journal of Periodontol- ogy 82: 377–387.
Trombelli, L., Farina, R., Marzola, A., Bozzi, L., Lil- jenberg, B. & Lindhe, J. (2008) Modeling and remodeling of human extraction sockets. Journal of Clinical Periodontology 35: 630–639.
Scarano, A., Piattelli, A., Assenza, B., Quaranta, A.,
Perrotti, V., Piattelli, M. & Iezzi, G. (2010) Por- cine bone used in sinus augmentation procedures: a 5-year retrospective clinical evaluation. The International Journal of Oral and Maxillofacial Surgery 68: 1869–1873.
bone grafting alone:
Froum S, Cho SC, Rosenberg E, Rohrer M, Tarnow D. Histological comparison of healing extraction sockets implanted with bioactive glass or demineralized freeze-dried bone allograft: A pilot study.
J Clin Periodontol 2002;73:94–102.
23. Zubillaga G, Von Hagen S, Simon BI, Deasy MJ. Changes in alveolar bone height and width following post-extraction ridge augmenta- tion using a xed bioabsorbable membrane and demineralized freeze-dried bone osteoinductive graft. J Periodontol 2003;74: 965–975.
xenograft:
Artzi Z, Nemcovsky CE. The application of deproteinized bovine bone mineral for ridge preservation prior to implantation. Clinical and histological observations in a case report. J Periodontol 1998; 69:1062–1067.
25. Carmagnola D, Adriaens P, Berglundh T. Healing of human extrac- tion sockets lled with Bio-Oss. Clin Oral Implants Res 2003;14: 137–143.
alloplast:
Sàndor GK, Kainulainen VT, Queiroz JO, Carmichael RP, Oikarinen KS. Preservation of ridge dimensions following grafting with coral granules of 48 post-traumatic and post-extraction dento-alveolar defects. Dent Traumatol 2003;19:221–227.
27. Guarnieri R, Pecora G, Fini M, et al. Medical grade calcium sulfate hemihydrate in healing of human extraction sockets: Clinical and histological observations at 3 months. J Clin Periodontol 2004;75:902–908.
solo membrane riassorbibili:
Lekovic V, Camargo PM, Klokkevold PR, et al. Preservation of alveo- lar bone in extraction sockets using bioabsorbable membranes.
J Clin Periodontol 1998;69:1044–1049.
solo memb non riass:
Diès F, Etienne D, Abboud NB, Ouhayoun JP. Bone regeneration in extraction sites after immediate placement of an e-PTFE membrane with or without a biomaterial. A report on 12 consecutive cases. Clin Oral Implants Res 1996;7:277–285.
Bartee BK. Extraction site reconstruction for alveolar ridge pres- ervation. Part 2: Membrane-assisted surgical technique. J Oral Implantol 2001;27:194–197.
membrana + graft
Iasella JM, Greenwell H, Miller RL, et al. Ridge preservation with freeze-dried bone allograft and a collagen membrane compared to extraction alone for implant site development: A clinical and histologic study in humans. J Clin Periodontol 2003;74:990–999.
Liberati A, Altman DG, Tetzla J; The Prisma Group. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: Explanation and elaboration. Br Med J 2009;339:b2700.
Blanco, J., Alves, C.C., Nunez, V., Aracil, L., Munoz, F. & Ramos, I. (2010) Biological width following immediate implant placement in the dog: Flap vs. Flapless surgery. Clinical Oral Implants Research 21: 624–631.
Caneva, M., Botticelli, D., Salata, L.A., Souza, S.L.S., Bressan, E. & Lang, N.P. (2010) Flap vs. “flapless” surgical approach at immediate implants: a histomorphometric study in dogs. Clinical Oral Implants Research 21: 1314–1319.
Engler-Hamm, D., Cheung, W.S., Yen, A., Stark, P.C. & Griffin, T. (2011) Ridge preservation using a composite bone graft and a bioabsorbable mem- brane with and without primary wound closure: a comparative clinical trial. Journal of Periodontol- ogy 82: 377–387.
Darby, I., Chen, S.T. & Buser, D. (2009) Ridge pres- ervation techniques for implant therapy. International Journal of Oral and Maxillofacial Implants 24: 260–271.
Barone, A., Ricci, M., Calvo-Guirado, J.L. & Covani, U. (2011) Bone remodelling after regen- erative procedures around implants placed in fresh extraction sockets: an experimental study in Beagle dogs. Clinical Oral Implants Research 22: 1131–1137.
Barone A, Borgia V, Covani U, Ricci M, Piattelli A, Iezzi G. Flap versus flapless procedure for ridge preservation in alveolar extraction sockets: a histological evaluation in a randomized clinical trial. Clinical Oral Implants Research 00, 2014, 1–8 doi: 10.1111/clr.12358
Hammerle, C.H., Arau jo, M.G. & Simion, M. (2012) Osteology Consensus Group 2011. Evidence- based knowledge on the biology and treatment of extraction sockets. Clinical Oral Implants Research, 23(Suppl. 5): 80–82.
Sbordone, L., Levin, L., Guidetti, F., Sbordone, C., Glikman, A. & Schwartz-Arad, D. (2011) Apical and marginal bone alterations around implants in maxillary sinus augmentation grafted with autogenous bone or bovine bone material and simultaneous or delayed dental implant posi- tioning. Clinical Oral Implants Research 22: 485–491.
Becker, W., Dahlin, C., Lekholm, U., Bergstrom, C., van Steenberghe, D., Higuchi, K. & Becker, B. E. (1999) Five-year evaluation of implants placed at extraction and with dehiscences and fenestra- tion defects augmented with eptfe membranes: results from a prospective multicenter study. Clinical Implant Dentistry & Related Research 1: 27–32.
Artzi, Z., Tal, H. & Dayan, D. (2000) Porous bovine bone mineral in healing of human extraction sockets. Part 1: Histomorphometric evaluations at 9 months. Journal of Periodontology 71: 1015– 1023.
Carmagnola, D., Adriaens, P. & Berglundh, T. (2003) Healing of human extraction sockets filled with bio-oss. Clinical Oral Implants Research 14: 137–143.
Vignoletti F, Matesanz P, Rodrigo D, Figuero E, Martin C, Sanz M. Surgical protocols for ridge preservation after tooth extraction. A systematic review.
Clin. Oral Impl. Res. 23(Suppl. 5), 2012, 22–38 doi: 10.1111/j.1600-0501.2011.02331.x
Fickl S, Schneider D, Zuhr O, Hinze M, Ender A, Jung RE, Hu ̈rzeler MB. Dimensional changes of the ridge contour after socket preservation and buccal overbuilding: an animal study. J Clin Periodontol 2009; 36: 442–448. doi: 10.1111/j.1600-051X.2009.01381.x.
Ridge preservation techniques for implant therapy. Darby I, Chen ST, Buser D. Int J Oral Maxillofac Implants. 2009; 24 Suppl():260-71.)

