Dott.ssa Natascia Raciti
L’ipersensibilità dentinale rappresenta una patologia odontoiatrica di grande interesse clinico. Si manifesta come sintomatologia dolorosa, generalmente localizzata ad uno o più elementi dentari che presentano esposizione del tessuto dentinale, evocata da stimoli di varia natura (termici, tattili, chimici od osmotici) i quali agiscono in assenza di altre patologie dentarie. Traumi cronici quali attrito, abrasione ed erosione a carico di elementi dentari vitali possono rimuovere in alcuni punti lo smalto o il cemento che normalmente proteggono la dentina provocandone l’esposizione ed il conseguente contatto diretto tra ambiente esterno intraorale e tessuto pulpare dentale [In alcuni individui può non esservi contatto a livello cervicale tra smalto e cemento per variabilità anatomica]. La comparsa dei sintomi dolorosi può colpire qualsiasi elemento dentario e pazienti di ogni età con maggior incidenza negli individui di sesso femminile che hanno dai 20 ai 40 anni (1, 2). Si osserva inoltre con maggior incidenza nei pazienti affetti da malattia parodontale (3, 4), con comparsa transitoria nei pazienti sottoposti a terapia di deep scaling, root planing e chirurgia parodontale (5) ed in corso di sbiancamento dentale e terapie conservative (6). Il ruolo del fattore placca batterica nella comparsa della patologia rimane tuttavia controverso. L’accumulo di placca sulle superfici radicolari e la sua azione demineralizzante della struttura dentaria può essere associata all’apertura degli orifici dei tubuli dentinali (7). Secondo alcuni autori i pazienti in grado di mantenere un buon controllo della placca hanno minore probabilità di sviluppare ipersensibilità dentinale (8). In opposizione a questi risultati appare interessante l’osservazione di molti pazienti che malgrado presentino recessioni gengivali associate a minimi accumuli di placca lamentano una sintomatologia da ipersensibilità dentinale (9,10).
Definizione: Sensazione di dolore breve ed intensa evocata da stimoli fisici o chimici non riconducibili ad altre patologie dentali (11)
Eziologia: L’associazione tra pervietà dei tubuli dentinali e sintomatologia dolorosa è spiegata dalla nota teoria idrodinamica di Brannstrom. L’applicazione di uno stimolo in grado determinare una perturbazione del fluido dentinale contenuto all’interno dei tubuli (contrazione, espansione, spostamento) che attiva meccanicamente i barocettori delle terminazioni nervose dell’organo pulpo-dentinale (fibre A-d) può causare dolore. La generazione del potenziale d’azione nel nervo intradentale è responsabile della sensazione dolorosa avvertita dal paziente (12, 13). In particolare l’abbassamento termico, la disidratazione ottenuta mediante getto d’aria, l’evaporazione e l’applicazione di uno stimolo osmotico (zucchero, acido, sale etc.) inducono lo spostamento centrifugo del fluido tubulare e sono in grado di attivare più efficacemente le terminazioni nervose rispetto a stimoli tattili e termici di innalzamento della temperatura che producono lo spostamento del fluido in direzione della polpa (14, 15). Il 75% dei pazienti affetti da ipersensibilità dentinale lamenta, infatti, dolore al contatto con uno stimolo termico (freddo) (16).
Lesione iniziale: L’apertura dell’estremità esterna dei tubuli dentinali si verifica quando lo smear layer o la sostanza intratubulare vengono rimossi (17) meccanicamente (abrasione) o chimicamente (erosione). [L’erosione acida sembra essere il fattore causale predominante (18)].
Sede delle lesioni: Il margine cervicale è interessato in più del 90% dei casi sia sul versante vestibolare che linguo-palatale (16). [La perdita di smalto e ancor più una recessione gengivale rappresentano gli elementi fondamentali nell’eziologia dell’esposizione dentinale (18)].
Prevalenza: Sostanziali differenze nell’ambito delle popolazioni studiate e dei metodi investigativi utilizzati dai diversi autori generano un ampio intervallo di valori di prevalenza (4-57%) (19, 20). La prevalenza dell’ipersensibilità dentinale varia dal 60 al 98% nei pazienti affetti da malattia parodontale (3). Il picco di incidenza cade alla fine della terza decade di vita e decresce nel corso della quarta e quinta decade (1, 2). La riduzione della permeabilità dentinale e della sensibilità nervosa col procedere dell’età, la formazione di dentina secondaria, l’uso prolungato di dentifrici e collutori al fluoro possono infatti occludere i tubuli dentinali esposti e ridurre la sensibilità (21).
Distribuzione: Premolari superiori, primo molare superiore e incisivi superiori ed inferiori sono gli elementi dentari maggiormente interessati dal fenomeno dell’ipersensibilità dentinale (22, 23). Essa sembra inoltre avere una leggera predilezione per il sesso femminile (22, 1, 24).
Diagnosi differenziale:
- lesione cariosa con interessamento dentinale
- iperemia pulpare
- frattura delle cuspidi
- restauri infiltrati
- solchi palato gengivali
- scheggiature o fratture dentali (25, 26)
- elementi preparati protesicamente in assenza di cementi definitivi.
Diagnosi clinica: La diagnosi può essere definita solo dopo aver raccolto i dati anamnestici del paziente, aver esaminato clinicamente e radiograficamente il caso e aver escluso altre condizioni patologiche (diagnosi differenziale). Il tipico dolore transitorio che si manifesta in risposta a stimolazione dell’elemento dentario colpito può essere provocato dall’operatore con l’uso di una sonda odontoiatrica o di un getto d’aria allo scopo di registrare la valutazione soggettiva del paziente sulla severità del disturbo e seguirne l’andamento nel tempo (11, 27).
Sintomatologia: L’ipersensibilità dentinale può presentarsi come sensazione non piacevole e non confortevole. Il dolore descritto dal paziente può essere definito lieve o intenso, vago o specifico, intermittente o costante (28).
Fattori di rischio:
- tecniche scorrette di spazzolamento
- uso scorretto del filo interdentale
- uso di dentifrici ad elevato indice di abrasività
- presenza di sostanze acide di origine esogena o endogena nel cavo orale
- traumi cronici dovuti ad abitudini viziate (digrignamento dei denti in situazioni di stress)
- piccole fratture dentali
- perdita di sostanza dentale al colletto del dente presumibilmente dovute a trauma occlusale (abfraction)
- interventi di chirurgia parodontale
- esposizione di dentina al colletto associata a perdita di gengiva aderente
- difetti dello sviluppo di smalto e dentina
- otturazioni fratturate
- preparazioni protesiche (esposizione di 70000 tubuli per mm2 ).
Terapia professionale: E’ un trattamento più complesso indicato nel caso di ipersensibilità localizzata ad uno o pochi elementi dentari. I principi attivi contenuti nei prodotti disponibili in commercio per il controllo dell’ipersensibilità dentinale sono:
- floruri: floruro di sodio in pasta dentifricia o in soluzione concentrata e floruro stannoso in soluzione acquosa o in gel a base di glicerina e carbossimetilcellulosa riducono in vitro la permeabilità della dentina (29) probabilmente attraverso la precipitazione di floruro di calcio insolubile sulla superficie dentinale promuovendo l’obliterazione dei tubuli esposti (7).
- Nitrato di potassio: gli ioni potassio contenuti in pasta dentifricia al 5% a bassa abrasività o in gel biadesivo al 5 e 10% grazie al loro effetto depolarizzante riducono l’eccitabilità nervosa in modelli animali (30, 31, 32).
- Ossalati: l’ossalato di potassio al 3% e l’ossalato ferrico al 6,8% riducono la permeabilità dentinale ed occludono i tubuli esposti più efficacemente in vitro (33, 34) che nella pratica clinica (35).
- Fosfato di calcio: occlude in vitro (36, 37) i tubuli dentinali e ne riduce la permeabilità.
- Idrossido di calcio: occlude i tubuli dentinali attraverso il legame degli ioni calcio ai radicali liberi proteici ed aumenta il grado di mineralizzazione della dentina esposta. Ha azione immediata ma di breve durata pertanto necessita di ripetute applicazioni (38) e può irritare il margine gengivale (39).
- Resine e adesivi: l’uso di questi materiali va riservata solo ai casi di ipersensibilità specifica e localizzata. Sebbene essi esplichino una buona azione desensibilizzante il rischio di rottura molecolare e conseguente esposizione dei tubuli resta elevato e rappresenta un limite nell’impiego di tali composti (28)
- Idrossinanoapatite: occlude i tubuli dentinali grazie alla capacità di formare un precipitato non riassorbibile ad alta affinità per le fibrille collagene.
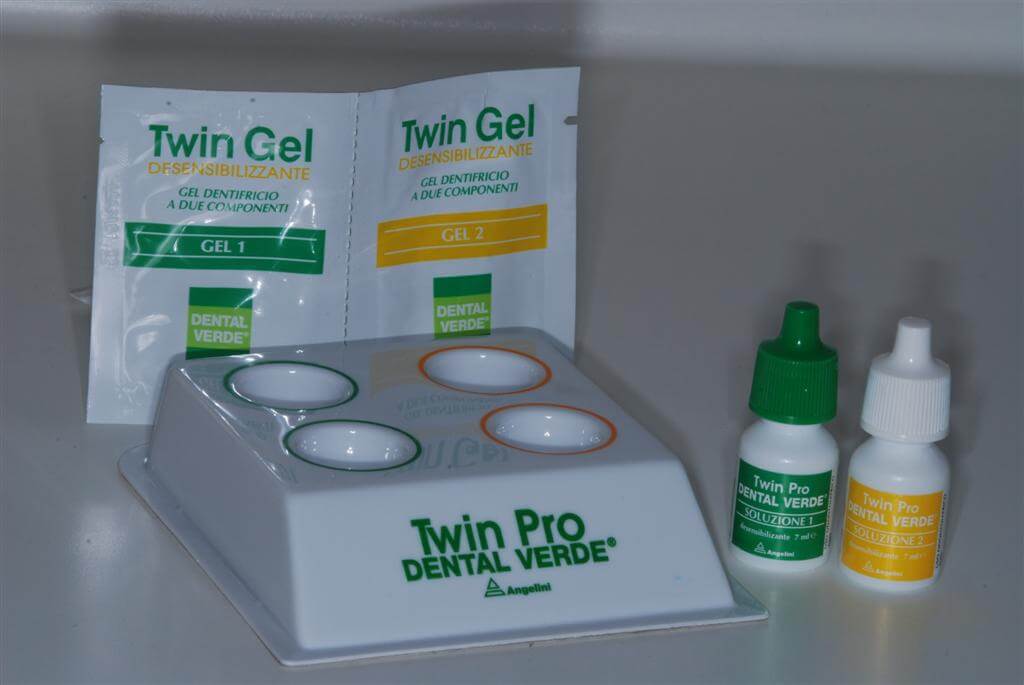
[Nella nostra pratica clinica un prodotto rivelatosi particolarmente efficace è la soluzione desensibilizzante per uso professionale Twin Pro che si compone di una soluzione di sali solubili di potassio (verde) in grado di inibire la stimolazione delle fibre nervose mediante rilascio prolungato di ioni potassio (meccanismo d’azione chimico) e di una soluzione di Sali solubili di calcio e stronzio (giallo) responsabile dell’occlusione meccanica dei tubuli dentinali (meccanismo d’azione fisico)].
Procedure alternative:
- Ionoforesi in associazione alla somministrazione di fluoro: grazie al flusso di corrente elettrica in grado di facilitare la diffusione degli ioni fluoro all’interno dei tessuti, tale trattamento comporta un’immediata riduzione della sensibilità. Tuttavia i sintomi tendono a ripresentarsi dopo un periodo di circa sei mesi (40).
- Utilizzo del laser: l’irradiazione con il laser Nd:YAG in associazione con la somministrazione di vernici contenenti floruro di sodio ha mostrato la capacità di occludere più del 90% dei tubuli dentinali (41) così come la terapia combinata laser CO2 –applicazione di gel al floruro stannoso si è rivelata efficace nell’occlusione dei tubuli per un periodo di circa sei mesi (42, 43).
Terapia domiciliare: ha il vantaggio di essere semplice e poco costosa ed indicata per il trattamento della ipersensibilità diffusa. I prodotti commerciali di impiego sono dentifrici e collutori contenenti uno o più agenti desensibilizzanti:
- Sali di potassio: dentifrici a base di nitrato di potassio al 5% o cloruro di potassio al 3,75% si sono dimostrati efficaci nella terapia desensibilizzante (44, 45)
- Sali di potassio e fluoro: dentifrici contenenti nitrato di potassio al 5% e fluoruro stannoso allo 0,454% veicolato da una pasta a base di silicio (44, 46) oltre a garantire una consistente riduzione dell’ipersensibilità dentinale hanno mostrato in uno studio in vitro di essere dotati della più bassa conduttanza idraulica e di fornire il più elevato flusso di ioni potassio all’interno del tessuto dentinale (47).
Ruolo degli eccipienti. Ulteriori studi sono necessari per determinare in che misura la presenza di altre sostanze come monofluorofosfato di sodio, fluoruro di sodio, fluoruro di stagno e agenti antiplacca possa compromettere l’azione desensibilizzante delle formulazioni suddette. Alcuni studi condotti sull’aggiunta degli agenti antiplacca triclosan e citrato di zinco hanno dimostrato che tali composti non interferiscono con l’efficacia dei prodotti a base di sali di potassio (nitrato e citrato di potassio) (45, 48).
Prevenzione: Uno degli aspetti tanto importante quanto spesso sottovalutato dalla maggior parte degli operatori odontoiatrici è quello relativo alle misure preventive. Un valido piano di trattamento dovrebbe prevedere l’identificazione e l’eliminazione dei fattori causali predisponenti come l’assunzione da parte del paziente di sostanze acide di origine esogena o la presenza di acidi endogeni che vengono a contatto con la cavità orale ed il trauma da spazzolamento. Il ruolo che gli agenti erosivi giocano nella comparsa dell’ipersensibilità dentinale è noto e ben documentato (26, 18). Fonti acide esogene (frutta, succo di frutta, yogurt, cola, vino) ed endogene (reflusso gastrico e rigurgito) sono in grado di provocare lesioni dello smalto (erosione) e di rimuovere lo smear layer ed aprire i tubuli dentinali. Il danno al tessuto dentale si aggrava associando all’assunzione di sostanze acide l’uso di dentifrici con elevato indice di abrasività (18).
La raccomandazione più appropriata da fare al paziente consiste nello sconsigliare di lavare i denti per almeno due o tre ore dopo il consumo di cibi o bevande acide per evitare il dannoso coeffetto erosione acida-abrasione (11, 18).
Conclusioni: Definire anamnesticamente il ruolo dei fattori causali della lesione da ipersensibilità rappresenta il punto di partenza per l’odontoiatra che si confronti con pazienti che riferiscono sintomi dolorosi da ipersensibilità dentinale. E’ importante identificare tali fattori allo scopo di programmare un corretto piano di trattamento che contempli, oltre alle strategie di management professionale e domiciliare, anche la prevenzione dell’ipersensibilità dentinale. La gestione del paziente con ipersensibilità può essere dunque affrontata con l’impiego di principi attivi che riducono drasticamente la sensibilità dentinale e, ancor più importante, fornendo le istruzioni relative all’eliminazione delle abitudini di vita scorrette responsabili delle recidive della patologia.
Bibliografia
1 J.Flynn, R.Galloway and R.Orchardson. The incidence of ‘hypersensitive’ teeth in the West of Scotland. Journal of Dentistry 13 (1985), pp. 230–236.
2 Irwin C R, McCusker P. Prevalence of dentine hypersensitivity in general dental population. J Irish Dent Assoc 1997; 43: 7-9.
3 MB Chabanski, DG Gillam, JS Bulman, HN Newman – J Clin Periodontol, 1996 Prevalence of cervical dentine sensitivity in a population of patients referredto a specialist Periodontology Department.
4 Rees JS, Jin LJ, Lam S, Kudanowska I, Vowles R. The prevalenceof dentine hypersensitivity in a hospital clinic population in Hong Kong. Journal of Dentistry, 2003; 31: 453-61.
5 B von Troil, I Needleman, M Sanz – A systematic review of the prevalence of root sensitivity following periodontal therapy Journal Of Clinical Periodontology, 2002; 29 (supplement 3): 173-7.
6 VB Haywood Dentine hypersensitivity: bleaching and restorativeconsiderations – International Dental, 2002; 52 (supplement 5) 376-84.
7 M Addy, P Dowell – Dentine hypersensitivity–a review. Clinical and in vitro evaluation of treatments. J Clin Periodontol, 1983; 10: 351-363.
8 Manochehr-Pour Clinical Evaluation of Two Potassium Nitrate Toothpaste for the Treatment of Dental Hypersensitivity”, Peridontal Case Reports 1984;6: 25-30.
9 M. Yoshiyama, Y. Noiri, K. Ozaki, A. Uchida, Y. Ishikawa and H. Ishida. Transmission electron microscopic characterization of hypersensitive human radicular dentin. J Dent Res 1990; 69: 1293-7.
10 Al-Wahadni A, Linden GJ: Dentine hypersensitivity in Jordanian dental attenders. A case control study. J Clin Periodontol 2002; 29: 688–693.
11 Canadian Advisory Board on Dentin Hypersensitivity. Consensus-Based Recommendations for the Diagnosis and Management of Dentin Hypersensitivity. J Can Dent. Assoc 2003;69(4):221-6.
12 Walters PA. Dentinal Hypersensitivity: A Review. J Contemp Dent Pract. 2005:6:107-117.
13 Addy M. Dentine hypersensitivity:. New perspectives on an old problem. Int Dent J 2002 52: 367–375.
14 Orchardson R, Cadden SW. An update on the physiology of the dentine-pulp complex. Dent Update 2001;28:200–9.
15 Matthews, B. and Vongsavan, N., 1994. Interactions between neural and hydrodynamic mechanisms in dentine and pulp. Arch. Oral Biol. 39, pp. 87S–95S.
16 Orchardson R, Collins WJ. Clinical features of hypersensitive teeth. Br Dent J 1987;162:253–6.
17 Dababneh RH, Khouri AT, Addy M: Dentine hypersensitivity– an enigma? A review of terminology, mechanisms, aetiology and management. Brit Dent J 1999;187:606-11.
18 Addy M, Hunter ML. Can tooth brushing damage your health? Effects on oral and dental tissues. Int Dent J 2003 53: 177-186.
19 Rees JS, Addy M. A cross-sectional study of dentine hypersensitivity. J Clin Periodontol 2002;29:997–1003.
20 Irwin CR, McCusker P. Prevalence of dentine hypersensitivity in a general dental population. J Ir Dent Assoc 1997;43(1):7–9.
21 Tillis TSI, Keating JG. Understanding and managing dentin. hypersensitivity. J Dent Hygiene 2002;76:296-310.
22 Fischer C, Fischer R G, Wennberg A. Prevalence and distribution of cervical dentine hypersensitivity in a population in Rio de Janeiro, Brazil. J Dent; Vol 20: 272–276. 1992.
23 M.B. Chabanski, D.G. Gillam, J.S. Bulman and H.N. Newman, Prevalence of cervical dentine sensitivity in a population of patients referred to a specialist periodontology department: a pilot study. Journal of Oral Rehabilitation 1997 24: 666-672.
24 Addy M, Mostafa P, Newcombe R. Dentine Hypersensitivity: the distribution of recession, sensitivity and plaque. J Dent. 1987; 15: 242-248.
25 Al-Sabbagh M, Andreana S, Ciancio SG. Dentinal hyper-. sensitivity: Review of aetiology, differential diagnosis, prevalence,. and mechanism. J Int Acad Periodontol 2004; 6: 8-12.
26 Addy M. Dentine hypersensitivity: definition, prevalence distribution and … Tooth wear and sensitivity: Clinical advances in restorative dentistry. London: Martin Dunitz; 2000: 239-48.
27 Holland GR, Narhi MN, Addy M, Gangarosa L, Orchardson R. Guidelines for the design and conduct of clinical trials on dentine hypersensitivity. J Clin Periodontal 1997;24:808-13.
28 Bartold, PM. Dentinal hypersensitivity: a review AUSTRALIAN DENTAL JOURNAL. 2006; VOL 51: (3): 212-218.
29 Greenhill JD, Pashley DH. The effects of desensitizing agents on the hydraulic conductance of human dentin in vitro. J Dent Res 1981;60: 686-698.
30 J.M. Peacock and R. Orchardson, Effects of potassium ions on action potential conduction in A- and C-fibers in rat spinal nerves, J Dent Res 74 (1995); 74: 634-41.
31 Markowitz K, Bilotto G, Kim S (1991). Decreasing intradental nerve activity in the cat with potassium and divalent cations. Arch Oral Biol 36:1–7.
32 Cuesta Frechoso S, Menéndez M, Guisasola C, Arregui I, Tejerina JM, Sicilia A: Evaluation of the efficacy of two potassium nitrate bioadhesive gels (5% and 10%) in the treatment of dentine hypersensitivity. A randomised clinical trial. J. Clin. Periodontol 2003; 30:15–320.
33 Gillam DG, Mordan NJ, Sinodinou AD, Tang JY, Knowles JC,. Gibson IR. The effects of oxalate-containing products on the exposed dentine surface: an SEM investigation. Oral Rehabil. 2001; 28:1037–1044. 38.
34 Pereira JC, Segala AD, Gillam DG. Effect of desensitizing agents on the hydraulic conductance of human dentin subjected to different surface pre-treatment: an in vitro study. Dent Mater 2005; 21:129 -38.
35 Orchardson R, Gillam DG. The efficacy of potassium salts as agents for treating dentin hypersensitivity. J Orofac Pain 2000; 14(1):9–19.
36 Suge T, Kawasaki A, Ishikawa K. Calcium phosphate precipitation method for the treatment of dentin hypersensitivity. Am J Dent. 2002 Aug ;15 (4):220-6.
37 A.P. Forsback, S. Areva and J.I. Salonen. Mineralization of dentin induced by treatment with bioactive glass S53P4 in vitro. Acta Odontol Scand. 2004 Feb ;62 (1):14-20.
38 Ling TY, Gillam DG. The effectiveness of desensitizing agents for the. treatment of cervical dentine sensitivity (CDS)—a review. J West Soc. Periodontol 1996; 44: 5-12.
39 Scherman A, Jacobsen PL: Managing dentin hypersensitivity: what treatment to recommend to patients. J Am Dent Assoc 1992;123(4):57-61.
40 Kern DA, McQuade MJ, Scheidt MJ, Hason B, Van Dyke. TE. Effect of sodium fluoride on tooth hypersensitivity. with or without iontophoresis. J Periodontol 1989; 60: 386-389.
41 Lan WH, Liu HC, Lin CP. The combined occluding effect of sodium fluoride varnish and Nd:YAG laser irradiation on human dentinal tubules. J-Endod. 1999 Jun; 25(6): 424-6.
42 Moritz A, Schoop U, Goharkhay K et al. Long-term effects of CO2 laser irradiation on treatment of hypersensitive dental necks: results of an in Vivo study. J Clin Laser Med Surg 1998; 16: 211–215.
43 Ciaramicoli MT, Carvalho RCR, Eduardo CP. Treatment of cervical dentin hypersensitivity using Neodymium: Yttrium-Aluminum-Garnet laser. Clinical evaluation. Lasers Surg Med 2003;33:358–62.
44 Schiff T, Zhang YP, DeVizio W, et al. A randomized clinical trial of the desensitizing efficacy of three dentifrices. Compend Cont Educ Dent. 2000;21(suppl 27):4-10.
45 Wara-aswapati N, Krongnawakul D, Jiraviboon D, Adulyanon S, Karimbux N, Pitiphat W. The effect of a new toothpaste containing potassium nitrate and triclosan on gingival health, plaque formation and dentine hypersensitivity, J Clin Periodontol 2005; 32: 53–58.
46 Sowinski JA, Battista GW, Petrone ME, et al. A new desensitizing dentifrice: an 8-week clinical investigation. Compend Contin Educ Dent 2000;21: 11-6.
47 Pashley DH, Agee K, Zhang Y, Smith A, Tavss EA, Gambogi RJ. The effects of outward forced convective flow on inward diffusion of potassium acrosshuman dentin. Am J Dent, 2002; 15: 256-61.
48 Yates R, Ferro R, Newcombe RG, Addy M. A. A comparison of a reformulated potassium citrate desensitising toothpaste with the original proprietary product. J Dent. 2005 Jan ;33 (1):19-25.
Dott.ssa Natascia Raciti
Racitinatasciaraciti@gmail.com
Per informazioni:
zerodonto@gmail.com

